
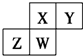
| A. | 原子半径:W>Z>Y>X | |
| B. | W的最高正价与最低负价的绝对值可能相等 | |
| C. | 气态氢化物的稳定性:Z>W>X>Y | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
分析 A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,据此可判断各原子半径大小;
B.W有可能为C元素,其最高正价与最低负价的绝对值都是4;
C.非金属性强弱为Y>X>W>Z,非金属性越强,对于气态氢化物越稳定;
D.Z可能为Al,氢氧化铝不是强碱.
解答 解:同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱.同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,
A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径大小为:Z>W>X>Y,故A错误;
B.W有可能位于第ⅣA,如C元素,最高正价与最低负价的绝对值都是4,故B正确;
C.非金属性强弱为Y>X>W>Z,所以氢化物的稳定性也是Y>X>W>Z,故C错误;
D.根据位置可判断,Z的最小原子序数是13,氢氧化铝是两性氢氧化物,而不是强碱,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确原子结构与元素周期律、元素周期律的关系为解答关键,注意掌握元素周期律的内容,试题培养了学生的灵活应用能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 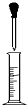 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 | |
| B. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| C. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 热化学方程式中,如果没有注明温度和压强,表示反应热是在25℃,101KPa测得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
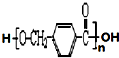
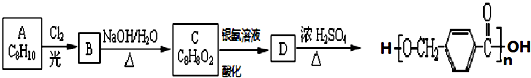
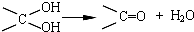
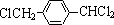 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.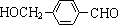 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$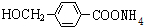 +2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n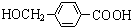 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$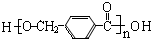 +(n-1)H2O
+(n-1)H2O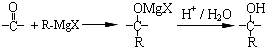
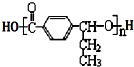 在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
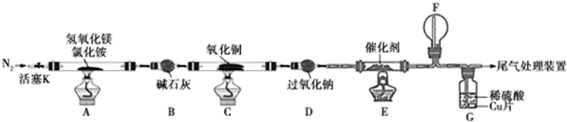
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)═2CO(g) 的△H=+172.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
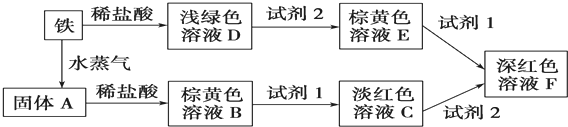
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y2?XY2 | D. | 2X2+Y2?2X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和Na2SO4溶液可以使蛋白质变性 | |
| B. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| C. | 从海带中提取碘单质的过程涉及氧化还原反应 | |
| D. | 镀锌铁桶镀层破损后铁仍不易被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com