
| A. | 氢氧化钠溶液 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 稀硝酸 |
科目:高中化学 来源: 题型:选择题
| A. | SiO2溶于水且显酸性 | |
| B. | 点燃是H2和Cl2化合的惟一条件 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | 液氯和氯水不是同一物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
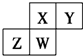
| A. | 原子半径:W>Z>Y>X | |
| B. | W的最高正价与最低负价的绝对值可能相等 | |
| C. | 气态氢化物的稳定性:Z>W>X>Y | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X元素在周期表中的位置只能是第二周期第ⅣA族 | |
| B. | 若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强 | |
| C. | 若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少 | |
| D. | 若X能形成XO32-、XO42-和X2O32-,Y能形成YO3-和XO4-,则X、Y一定在同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| C. | 葡萄糖注射液能产生丁达尔效应,属于胶体 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com