
分析 实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水,氯气溶于水和水发生反应生成盐酸和次氯酸,检验溶液中氯离子可以利用硝酸银溶液中的银离子结合氯离子生成氯化银沉淀检验存在.
解答 解:实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,氯气溶于水和水发生反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O=HClO+H++Cl-,检验溶液中氯离子可以利用硝酸银溶液中的银离子结合氯离子生成氯化银沉淀检验存在,Ag++Cl-=AgCl↓,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;Cl2+H2O=HClO+H++Cl-;硝酸银溶液.
点评 本题考查了氨气实验室制备,氯气性质和离子检验,注意基础知识的积累,题目较简单.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
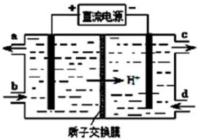
科目:高中化学 来源: 题型:解答题
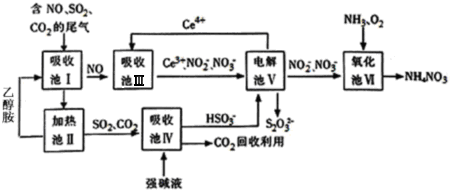
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| C. | SO2、SiO2、CO均为酸性氧化物 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
查看答案和解析>>
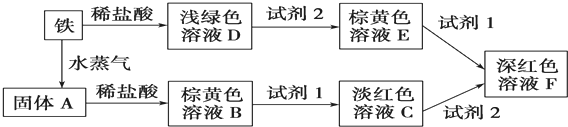
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com