
下列中学常见实验的现象或表述正确的是
A.过量的铁粉投入到一定量的热浓硫酸中,产生气体通入浓NaOH溶液,全部溶解
B.制备硅酸胶体时,向硅酸钠溶液中滴加盐酸,边加边搅拌,即可制得硅酸胶体
C.将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近,可产生大量白烟
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会儿,然后冷却、过滤,滤纸上的物体为“蓝色固体”
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2016届辽宁省高三10月月考化学试卷(解析版) 题型:选择题
除去下列物质中所含的杂质,选用的试剂正确的是
选项 | 物质(杂质) | 试剂 |
A | Al2O3(SiO2) | NaOH溶液 |
B | CO2(SO2) | Na2CO3溶液 |
C | FeCl2溶液(FeCl3) | Fe粉 |
D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
以下数值大于或等于阿伏加德罗常数的是
A.6g石墨中的共价键数目
B.常温常压下,17g ND3中所含分子数目
C.向0.2mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目
D.0.1mol羟基(—OH)中所含电子数目
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应
②弱酸与盐溶液反应可以生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液体系为中性
⑤有单质参加的非氧化还原反应
⑥两种氧化物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省牡丹江市高三9月月考化学试卷(解析版) 题型:填空题
(10分)元素X、Y、Z、W、M、N原子序数依次增大。X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期。它们四者原子序数之和为22,最外层电子数之和为16。在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构。请回答下列问题:
(1)M元素在周期表中的位置是 ,X、Y、Z、W、M的原子半径由大到小的顺序为 (用元素符号表示)。
(2)写出Y2X2的电子式 ;Z2X4结构式 。
(3)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味,且能使品红溶液褪色的气体放出,该反应的离子方程式为 。
(4)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式 。
(5)写出足量NW2通入硝酸钡溶液中的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第一次月考化学试卷(解析版) 题型:实验题
海水中含有丰富的镁资源。锂(Li)与镁元素性质相似。
(1)某同学设计了从模拟海水中制备MgO的实验方案:
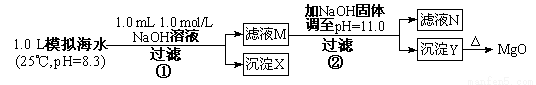
模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12 请回答:沉淀物X为 (写化学式);滤液N中存在的金属阳离子为 ; 步骤②中若改为加入 4.2 gNaOH固体,沉淀物Y为 (写化学式)。 (2)物质的量为0.10 mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是 ; (3)锂电池是新一代高能电池,目前已研究成功多种锂电池。某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 (4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂。
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为 。 ②调整PH=5-6的目的是 。 查看答案和解析>> 科目:高中化学 来源:2016届黑龙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题 用下列实验装置进行相应实验,设计正确且能达到实验目的的是
A.用图1所示装置制取少量H2 B.用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物 C.用图3所示装置验证Na和水反应的热效应 D.用图4所示装置蒸干A1Cl3溶液制备无水AlC13 查看答案和解析>> 科目:高中化学 来源:2015-2016学年河北省高二9月月考化学试卷(解析版) 题型:实验题 某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题: (1)本实验中用稍过量的NaOH的原因是 。在大小烧杯中填充泡沫塑料的作用是 。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g·℃),则写出该反应的热化学方程式 (ΔH值保留到小数点后1位)。 (3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的ΔH________(填“偏大”、“偏小”或“不变”),其原因是___________。 (4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热ΔH会____________(填“偏大”、“偏小”或“不变”)。 查看答案和解析>> 科目:高中化学 来源:2015-2016学年河北省邯郸市高一上第一次月考化学试卷(解析版) 题型:选择题 V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为 A. C. 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |