
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、C、H,它们之间能发生如下图的反应(图中有些反应的产物和反应的条件没有全部标出)。
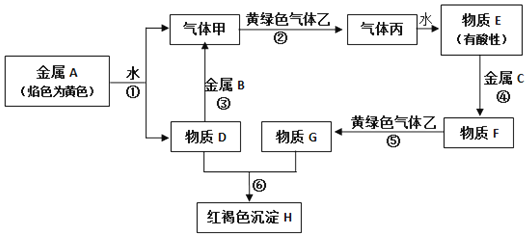
请根据以上信息回答下列问题:
(1)写出下列物质化学式:A_____、B_____、C____、F____、H_____、乙____。
(2)写出下列反应的化学方程式:
反应①______________________________。
反应③________________________________。
反应⑤_________________________________。
(3)物质G中的阳离子如何检验____________________________。
【答案】NaAlFeFeCl2Fe(OH)3Cl22Na+2H2O=2NaOH+H2↑2Al+2H2O+2NaOH=2NaAlO2+3H2↑2FeCl2+Cl2=2FeCl3加KSCN溶液有红色出现,或加氢氧化钠溶液有红褐色沉淀产生
【解析】
金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al。黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸。氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题。
根据以上分析可知A是Na,B是Al,C是铁,D是氢氧化钠,E是盐酸,F是氯化亚铁,G是氯化铁,H是氢氧化铁,甲是氢气,乙是氯气,丙是氯化氢。则
(1)根据以上分析可知A、B、C、F、H、乙的化学式分别是Na、Al、Fe、FeCl2、Fe(OH)3、Cl2。
(2)根据以上分析可知反应①的方程式为2Na+2H2O=2NaOH+H2↑;反应③的方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑;反应⑤的方程式为2FeCl2+Cl2=2FeCl3;
(3)由以上分析可知G为FeCl3,则物质G中阳离子的操作方法为取物质G少许于试管中,向其中滴加少量的KSCN溶液,溶液变为红色,证明物质G中有Fe3+离子,或加氢氧化钠溶液有红褐色沉淀产生。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若反应X+Y=M是放热反应,该反应一定不用加热
B.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
C.化学反应伴随的能量有热能和电能二种
D.热值指一定条件下,每1mol的物质完全燃烧所放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l)E.BaSO4(s) F.NaHSO4(aq) G.石墨(s) H.蔗糖(s) I.NaOH(l) J.硫酸 K.盐酸
(1)属于非电解质的是____________(填序号,下同),属于强电解质的是____________,属于弱电解质的是____________。
(2)能直接导电的是________________,电解质中能溶于水,且水溶液能导电是________________。
【答案】 BH AEI J D FGIK ADIJ
【解析】电解质是酸、碱、盐和活泼金属氧化物,非电解质是除了电解质之外的所有化合物。强电解质是强酸、强碱和盐,弱电解质是弱酸、弱碱和水。注意:单质既不是电解质也不是非电解质。(1)属于非电解质的是乙醇和蔗糖,强电解质是碘化钾(盐)、硫酸钡、氢氧化钠和硫酸(注意:F是硫酸氢钠溶液,K是HCl溶液,都属于混合物),弱电解质是醋酸。
(2)固体导电要求是金属或者石墨,熔融状态导电的要求是离子化合物,溶液导电要求是溶液中存在能只有移动的离子(电解质电离)。所以直接导电的是硫酸氢钠溶液、石墨、氢氧化钠溶液、盐酸。属于电解质,能溶于水,且能导电(本条件多余,电解质能溶于水,则其溶液一定导电)的是碘化钾、醋酸、氢氧化钠、硫酸。硫酸钡不溶。
【题型】填空题
【结束】
18
【题目】根据下列事实,完成相关的离子方程式或化学式,必要时可加一定文字说明:
(1)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂_____________________。
(2)泡沫灭火器的化学原理________________________________________________。
(3)热的纯碱溶液清洗油污___________________________________________。
(4)加热蒸干FeCl2水溶液并灼烧,得到物质的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化镁(MgBr2)可由金属镁在室温下与干燥后的溴在乙醚中反应制得,利用如图所示装置制备溴化镁,并测定其产率。已知:
①Mg和Br2反应剧烈且放热,MgBr,2具有强吸水性;
②MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5.
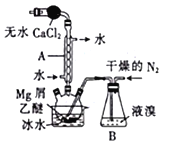
(1)保存液溴时在瓶内加入适量的蒸馏水,其目的是___________。
(2)球形干燥管中放入无水CaCl2的作用是______________,仪器A的名称是________。
(3)实验时,应缓慢通入干燥的氮气,直至溴完全导入三颈烧瓶中。如果将所用液溴一次性全部加入三颈烧瓶中,其后果是___________________。
(4)反应完毕后恢复至室温过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得到三乙醚合溴化镁(MgBr2·3C2H5OC2H5)粗品。第一次过滤得到的固体物质是_______。
(5)常温下用苯溶解粗品,冷却至0℃,析出晶体,经操作a得到三乙醚合溴化镁,加热至160℃分解得到无水MgBr2产品。
①操作a是________________。
②写出三乙醚合溴化镁加热至160℃分解得无水MgBr2的化学方程式:_______________。
(6)反应开始前装入5.0g镁屑和150mL无水乙醚,无水MgBr2在干燥器中冷却到室温后,称量,其质量为29.8g。则该实验制取MgBr2的产率是__________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理如图。下列有关氢氧燃料电池的说法正确的是( )

A. 该电池工作时电能转化为化学能
B. 该电池中b电极是负极
C. 外电路中电子由b电极通过导线流向a电极
D. 该电池的总反应:2H2+O2===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是
A. 铝片放入NaOH 溶液中有气体产生: 2Al+ 2OH-+ 2H2O=2AlO2-+3H2↑
B. 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色) + 2H+
2CrO42-(黄色) + 2H+
C. 用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4 + CO32- ![]() CaCO3+ SO42-
CaCO3+ SO42-
D. 向Na2SiO3溶液中通入过量CO2制各硅酸凝胶:SiO32-+ CO2 + H2O=H2SiO3(胶体) + CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以惰性电极电解CuSO4和NaCl 的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是
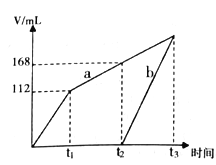
A. 原溶液中CuSO4和NaCl物质的量之比为1:1
B. a表示阴极上产生的气体,前产生的为Cl2
C. 若t1时溶液的体积为1L,此时溶液的pH 为13
D. 若原溶液体积为1L,则原溶液中SO42- 的物质的量浓度为0.2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com