
下列各组在溶液中的反应,无论反应物的量多少,都能用同一离子方程式表示的是
A.Ba(OH)2与H2SO4 B. FeBr2与Cl2
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 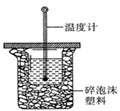 mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越
越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
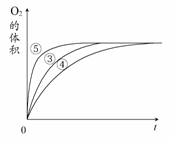
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,AgBr的Ksp=4.9×10-13 mol2·L-2、AgI的Ksp=8.3×10-17 mol2·L-2 下列说法正确的是:
A、在常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数
B在常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17 mol2·L-2
C常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14 mol/L
D、向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是
A.SO2和CO2都是酸性氧化物,都能与NaOH溶液反应
B.Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同
C.NO和NO2的密度都比空气大,都可以用向上排空气法收集
D.C3H8和CH3CH2OH相对分子质量相近,二者沸点也相近
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列离子方程式
(1)用食醋清除水垢(主要成分是CaCO3):
(2)含有氢氧化铝的胃药能降低胃酸:
(3)用惰性电极电解饱和氯化钠溶液:
(4)向硫酸氢钠溶液中加氢氧化钡溶液至恰好沉淀:
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
在36 g 碳不完全燃烧所得气体中,CO占 体积,CO2占
体积,CO2占 体积,且
体积,且
C(s) + 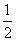 O2(g) = CO(g) △H = -110.5 kJ/mol
O2(g) = CO(g) △H = -110.5 kJ/mol
CO(g) + 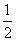 O2(g) = CO2(g) △H = -283 kJ/mol
O2(g) = CO2(g) △H = -283 kJ/mol
与这些碳完全燃烧相比,损失的热量是
A.172.5 kJ B. 1149 kJ C.283kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
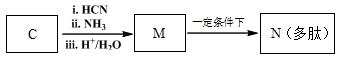
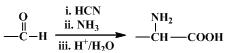
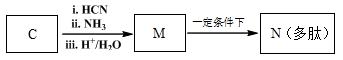
 高分子化合物G是作为锂电池中 Li+ 迁移的介质,合成G的流程如下:
高分子化合物G是作为锂电池中 Li+ 迁移的介质,合成G的流程如下:
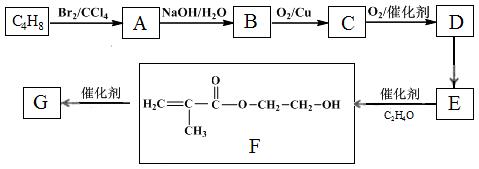
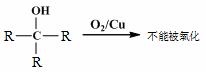
已知:①
②
(1)D的官能团名称是 。
(2)A→B的反应类型是 。
(3)C的结构简式是 。
(4)D→E反应条件是 。
(5)G的结构简式是 。
(6)已知:
M→N的化学方程式是 。
(7)D的同分异构体中,写出有顺反异构的结构简式
注意:①两个羟基连在同一个碳上,羟基连在双键的碳上的结构不稳定都不予考虑。
②不考虑过氧键和环状结构 ③顺反结构均写出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com