
����Ŀ������[KAl(SO4) 2 ��12H2O]������ˮ�����������Ҵ������������������й㷺��;�������������ķ����������ң���Al��Al2O3��������SiO2��FeO��xFe2O3���Ʊ������Ĺ����������£�

�ش��������⣺
��1�����ʱΪ������Ľ�ȡ�ʣ��ɲ�ȡ�Ĵ�ʩ��_________�����ţ���
a������ͬŨ�ȵ����� b���������ν�ȡ
c����ȡʱ������һ�� d���ʵ������¶�
��2������1�ijɷ���__________������2�������������Ƶ�һ�ָ�Ч�����߷��ӻ��������仯ѧʽΪ[Fe2(OH)n(SO4)(3-0.5n)]m�������������Ԫ�صĻ��ϼ�Ϊ___________��
��3��������ҺA�к���Fe2+��ʵ�鷽����������________________________________________��
��4����֪������Ksp[Fe(OH)3]=4.0��10-38����������Һ��pH=3ʱ����Һ��c(Fe3+)=____________��
��5���������а�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ�����ʹ�þƾ�ϴ�����������Ŀ����___________________________________________________________________��������ˮ��ԭ����_______________________________________��д���ӷ���ʽ����
��6����֪��pH=3�ͼ��������£�MnO4-����Mn2+��Ӧ����MnO2������������ͼ�м�������MnSO4������Ӧ�����ӷ���ʽΪ_________________________��
���𰸡� bd SiO2 +3 ȡ������ҺA���Թ��У����뼸�����Ը��������Һ�����������Һ��ɫ��˵����ҺA�к���Fe2+����ȡ������ҺA���Թ��У����뼸�����軯����Һ��������ɫ������˵����ҺA�к���Fe2+�� 4.0��10-5 mol��L-1 �����Ҵ����ӷ��Դ���ˮ�֣�ʹ������ٱ�� Al3++3H2O![]() Al(OH)3�����壩+3H+ 3Mn2++2MnO
Al(OH)3�����壩+3H+ 3Mn2++2MnO![]() +2H2O=5MnO2��+4H+
+2H2O=5MnO2��+4H+
�����������ң���Al��Al2O3��������SiO2��FeO��xFe2O3�����������ϡ�������ܹ��ˣ���ҺΪ��������������������������������Ϊ��������Ͳ��������ʣ���ҺA�м����Թ������������Һ������������Ϊ�����ӣ�������ҺpHʹ������ȫ�������������Ӳ��������������������̳�ȥ�����ĸ�����������˵õ��������̹��������������������Һ��Ҫ����������Һ���������������Ũ������ȴ�ᾧ��������ϴ��������õ��������ؾ��壻��
��1��a������ͬŨ�ȵ�������������������������a����b���������ν�ȡ��������Ľ�ȡ�ʣ�b��ȷ��c����ȡʱ������һ�벻��������Ľ�ȡ�ʣ�c������d���ʵ������¶ȿ�������Ľ�ȡ�ʣ�d��ȷ����ѡbd����2���������Ϸ�����֪����1�ijɷ���SiO2�����ݻ������������۴�����Ϊ0��֪����������Ԫ�صĻ��ϼ�Ϊ![]() ������3���������������ø��������Һ�����軯����Һ��ʵ�����Ϊ��ȡ������ҺA���Թ��У����뼸�����Ը��������Һ�����������Һ��ɫ��˵����ҺA�к���Fe2+����ȡ������ҺA���Թ��У����뼸�����軯����Һ��������ɫ������˵����ҺA�к���Fe2+������4����Һ��pH=3ʱ��������Ũ����1��10��11mol/L������������������ܶȻ�������֪��Һ��c(Fe3+)��
������3���������������ø��������Һ�����軯����Һ��ʵ�����Ϊ��ȡ������ҺA���Թ��У����뼸�����Ը��������Һ�����������Һ��ɫ��˵����ҺA�к���Fe2+����ȡ������ҺA���Թ��У����뼸�����軯����Һ��������ɫ������˵����ҺA�к���Fe2+������4����Һ��pH=3ʱ��������Ũ����1��10��11mol/L������������������ܶȻ�������֪��Һ��c(Fe3+)��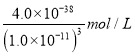 ��4.0��10��5mol/L����5�������Ҵ����л��ܼ���ˮ���ܣ����ӷ�������ʹ�þƾ�ϴ�����������Ŀ���������Ҵ����ӷ��Դ���ˮ�֣�ʹ������ٱ�ɣ���������ˮ������ˮ�����������������������������ʵ����ö���ˮ����Ӧ�����ӷ���ʽΪ��Al3++3H2O
��4.0��10��5mol/L����5�������Ҵ����л��ܼ���ˮ���ܣ����ӷ�������ʹ�þƾ�ϴ�����������Ŀ���������Ҵ����ӷ��Դ���ˮ�֣�ʹ������ٱ�ɣ���������ˮ������ˮ�����������������������������ʵ����ö���ˮ����Ӧ�����ӷ���ʽΪ��Al3++3H2O![]() Al(OH)3�����壩+3H+����6����pH=3�����������£�MnO4������Mn2+��Ӧ����MnO2����˼���MnSO4������Ӧ�����ӷ���ʽΪ��3Mn2++2MnO4��+2H2O��5MnO2��+4H+��
Al(OH)3�����壩+3H+����6����pH=3�����������£�MnO4������Mn2+��Ӧ����MnO2����˼���MnSO4������Ӧ�����ӷ���ʽΪ��3Mn2++2MnO4��+2H2O��5MnO2��+4H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ӻ��������(����)
A. SO2 B. NaClO C. H2SO4 D. CH3CHO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʷ����˵����ȷ����
A. SO2��CO2���ܺͼ���Һ��Ӧ������������������
B. ���ᡢ�������ʯ�ҷֱ������ᡢ�������
C. �������ڻ�����Һ�ȡ�Ũ��������ڴ�����
D. ����������һ���Ƿǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��ֱ�����ˮ��ϲ������ú���Һ��Ϊ���㣬�²㼸����ɫ����
A. �ƾ� B. �� C. CCl4 D. ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��ϵͳ�������� ![]() ������Ϊ2,6����5�һ�����
������Ϊ2,6����5�һ�����
B. ������ʰ�����ˮ����������4�ֶ���
C. ������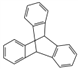 �Ƿ����廯����
�Ƿ����廯����
D. ������������ķ���ʽΪC3H5N3O9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������63%��ŨHNO3 �����ܶ�Ϊ1.4g/mL������240mL 0.50mol/LϡHNO3 �� ��ʵ�������У�A.10mL��Ͳ B.50mL��Ͳ C��������ƽ D�������� E.100mL����ƿ F.250mL����ƿ G.500mL����ƿ H����ͷ�ι� I.200mL�ձ���
��1����Ũ��������ʵ���Ũ��Ϊmol/L
��2��Ӧ��ȡ63%��Ũ����mL��Ӧѡ�� �� ������������ĸ��ţ�
��3��ʵ��ʱ����ѡ�õ������У�����ţ� D��I��
��4�����ƹ����У����в�����ʹ���Ƶ�ϡ������ҺŨ��ƫ�ߵ��ǣ�����ţ� ����ȡŨ�������Ͳ������ˮϴ��2��3�Σ�����ϴ��Һת������ƿ
������ƿʹ��ʱδ����
���ܽ��δ����ȴ����Һ
�ܶ���ʱ��С������������ˮ�ε�ƿ��
�ݶ��ݺ���ҡ�ȡ����ã�����Һ����ڿ̶��ߣ��ټ�����ˮ�����̶���
��5������ƿ��һ�־���ϸ��������ƿ�������侱��ϸ����������������ƿ������Һ��ʱ����Ҫһ�������ĺͼ��ɣ����˽��齫����ƿ��ƿ���Ĵ֣��Ըý������ȷ������
A.�����˽���Ľ�������ʹ������ƿ
B.���ܰ��˽���Ľ�����Ϊ�ή������ƿ�ľ�ȷ��
C.���ؼӴ�ƿ������Ϊ������ƿ��ת��Һ��ʱ��������Һ�嵹��ƿ�⣬�������Һ��Ũ�Ȳ���̫��Ӱ�죮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿʳƷ����DZ�֤ʳƷ��ȫ�����������������Ҫ�ٴ룬�������ʲ�����ʳƷ��ȫ��ⷶ����� �� ��
A�������谷 B���յ��� C���������� D��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com