
【题目】实验室用63%的浓HNO3 (其密度为1.4g/mL)配制240mL 0.50mol/L稀HNO3 , 若实验仪器有:A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯.
(1)此浓硝酸的物质的量浓度为mol/L
(2)应量取63%的浓硝酸mL,应选用 . (填仪器的字母编号)
(3)实验时还需选用的仪器有(填序号) D、I、
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号) ①量取浓硝酸的量筒用蒸馏水洗涤2﹣3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(5)容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中移入液体时,需要一定的耐心和技巧.有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是
A.可以按此建议改进,便于使用容量瓶
B.不能按此建议改进,因为会降低容量瓶的精确度
C.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响.
【答案】
(1)14.0
(2)8.9;A
(3)F、H
(4)①③
(5)B
【解析】解:(1)浓硫酸物质的量浓度c= ![]() =
= ![]() =14.0mol/L,故答案为:14.0;(2)由于无240mL容量瓶,故应选用250mL容量瓶,配制出250mL溶液,设需要的浓硝酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀:14.0mol/L×VmL=250mL×0.50mol/L,解得V=8.9mL;根据“大而近”的原则,根据需要量取的浓硝酸的体积为8.9mL,故应选择10mL量筒,
=14.0mol/L,故答案为:14.0;(2)由于无240mL容量瓶,故应选用250mL容量瓶,配制出250mL溶液,设需要的浓硝酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀:14.0mol/L×VmL=250mL×0.50mol/L,解得V=8.9mL;根据“大而近”的原则,根据需要量取的浓硝酸的体积为8.9mL,故应选择10mL量筒,
故答案为:8.9;A;(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有10mL量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故还需要的仪器有250mL容量瓶和胶头滴管,
故答案为:F、H;(4)①量取浓硝酸的量筒用蒸馏水洗涤2﹣3次,并把洗涤液转入容量瓶,会导致溶质的量偏多,则浓度偏高,故①正确;②容量瓶使用时未干燥,对浓度无影响,故②错误;③溶解后未经冷却就移液,则冷却后溶液体积偏小,浓度偏高,故③正确;④定容时不小心有少量蒸馏水滴到瓶外,会导致溶质的损失,则浓度偏低,故④错误;⑤定容后经振荡、摇匀、静置,发现液面低于刻度线是正常的,再加蒸馏水补至刻度线会导致浓度偏低,故⑤错误.
故答案为:①③;(5)容量瓶的瓶颈改粗,会降低容量瓶的精确度,
故答案为:B.
(1)根据物质的量浓度c= ![]() 来计算;(2)设出需要的浓硝酸的体积,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;(4)根据c=
来计算;(2)设出需要的浓硝酸的体积,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;(4)根据c= ![]() 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;(5)容量瓶的瓶颈改粗,会降低容量瓶的精确度.
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;(5)容量瓶的瓶颈改粗,会降低容量瓶的精确度.


科目:高中化学 来源: 题型:
【题目】下列有关食品添加剂的说法中,正确的是( )
A.山梨酸钾是一种常见的疏松剂
B.在规定范围使用着色剂,一般认为对人体健康无害
C.碳酸氢钠具有碱性,是一种常见的调味剂
D.为增强食品营养,应大力提倡在食品中添加营养强化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4) 2 ·12H2O]易溶于水,不易溶于乙醇,在生产、生活中有广泛用途。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量的SiO2、FeO·xFe2O3)制备明矾的工艺流程如下:

回答下列问题:
(1)酸浸时为提高铝的浸取率,可采取的措施是_________(填标号)。
a.改用同浓度的硝酸 b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(2)滤渣1的成分是__________;滤渣2经过处理可以制得一种高效的无机高分子混凝剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为___________。
(3)检验滤液A中含有Fe2+的实验方案及现象是________________________________________。
(4)已知常温下Ksp[Fe(OH)3]=4.0×10-38,当调节溶液的pH=3时,溶液中c(Fe3+)=____________。
(5)操作Ⅱ中包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,使用酒精洗涤明矾晶体的目的是___________________________________________________________________;明矾净水的原理是_______________________________________(写离子方程式)。
(6)已知在pH=3和加热条件下,MnO4-可与Mn2+反应生成MnO2,则上述流程图中加入适量MnSO4发生反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的俗称和分类都正确的是
A. CuSO45H2O(胆矾、混合物) B. Cu2(OH)2CO3(铜绿、盐)
C. Na2CO3(纯碱、碱) D. Ca(OH)2(生石灰、碱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
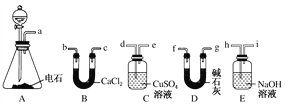
(1)A中制取乙炔的化学方程式为_________________________________。
(2)制乙炔时,旋开分液漏斗的活塞,使水慢慢滴下的原因是_________________。
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用________(填序号,下同)装置,干燥乙炔最好选用________装置。
(4)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
纯净乙炔气![]() 混合液
混合液![]() 有机混合物Ⅰ
有机混合物Ⅰ![]() 混合液
混合液![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃类分子中的碳原子与其它原子的结合方式是( )
A. 只通过两个共价键 B. 只通过非极性键 C. 形成四对共用电子对 D. 通过离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g)△H <0,下列说法正确的( )
2AB2(g)△H <0,下列说法正确的( )
A. 升高温度有利于反应速率增加,从而缩短达到平衡的时间
B. 升高温度,正向反应速率增加,逆向反应速率减小
C. 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com