
下列说法中,正确的是
A.具有较高能量的分子是活化分子
B.活化分子间的碰撞一定是有效碰撞
C.反应的活化能大小不会影响化学反应速率
D.不同化学反应需要的活化能有可能差别很大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列实验能够成功的是 ( )
A. 只用溴水一种试剂可鉴别甲苯、己烯、乙醇、四氯化碳四种液体
B. 用苯和溴水在Fe催化下可制的溴苯
C. 用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯
D. 用酚酞可鉴别苯酚钠和乙酸钠两种溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有说法不正确的是
A.离子晶体的晶格能是气态离子形成1mol晶胞时放出的能量
B.金属的六方最密堆积和面心立方最密堆积的空间利用率最高
C.钠晶胞结构如右图,钠晶胞中每个钠原子的配位数为8
D.温度升高,金属的导电性将变小

查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L的密闭容器中进行反应N2(g) + 3H2(g)  2NH3(g),2 min末N2的物质的量 由20 mol减小到8 mol,则2 min末N2的反应速率为
2NH3(g),2 min末N2的物质的量 由20 mol减小到8 mol,则2 min末N2的反应速率为
A.1.2 mol/(L·min) B.1 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g) 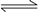 2C(g);ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是
2C(g);ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是
A.正反应速率加大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率减小,平衡向正反应方向移动
D.正反应速率和逆反应速率减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离过程为H2O  H++OH- ,不同温度下水的离子积常数为:
H++OH- ,不同温度下水的离子积常数为:
K(25℃)=1.0×10-14, K(35℃)=2.0×10-14。则下列叙述正确的是
A.c(H+)随着温度的升高而降低 B.在35℃时,c(H+)>c(OH_)
C.水的电离程度(25℃) >(35℃) D.水的电离是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)能说明该反应达到化学平衡状态的是 。
① CO2减少的化学反应速率和CO减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为0
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得 c(CO) = 0.0080 mol/L ,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol
 化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O=O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O=O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )
A.释放1638kJ的能量
B.吸收1638kJ的能量
C.释放126kJ的能量
D.吸收126kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com