
【题目】依据下列甲、乙、丙三图判断,下列叙述不正确的是
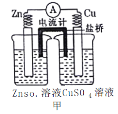
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.丙装置中,若粗铜中含有Au、Ag、Fe、Zn等杂质,电解后Au、Ag形成阳极泥
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:
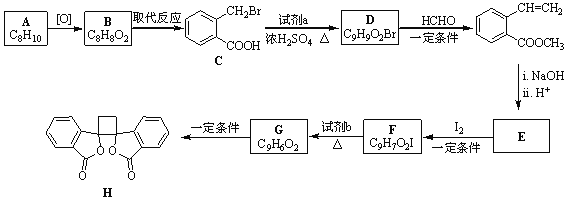
已知:i.RCH2Br![]() R-HC=CH-R’;
R-HC=CH-R’;
ii.R-HC=CH-R’![]() ;
;
iii.R-HC=CH-R’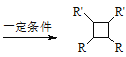 (以上R、R’、R”代表氢原子、烷基或芳基等)
(以上R、R’、R”代表氢原子、烷基或芳基等)
(1)A属于芳香烃,A的名称是___。
(2)由C生成D的化学方程式是___。
(3)由E与I2在一定条件下反应生成F的化学方程式是___;此反应同时生成另外一种与F互为同分异构体的有机副产物(不考虑立体异构),此有机副产物的结构简式是___。
(4)下列说法正确的是___(填字母代号)。
a.G存在顺反异构体
b.由G生成H的反应是加成反应
c.1mo1G最多可以与1mo1H2发生加成反应
d.1mo1F或1mo1H与足量NaOH溶液反应,均消耗2mo1NaOH
(5)试剂b是___。
(6)E有多种同分异构体,其中属于芳香族化合物,并既能发生加聚反应又能发生水解反应的有___种(不考虑立体异构)。写出其中任意一种核磁共振氢谱为5组峰,且峰面积之比为1:1:2:2:2的物质的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。
(3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
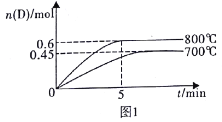
【题目】在容积为10L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图1。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图1。
试回答下列问题:
(1)能判断上述反应达到化学平衡状态的依据是________________(填写字母)
A.器中压强不变
B.混合气体中c(A )不变
C.2v (B ) =v (D ) D.c(A) =c(C)
(2)利用图1中数据计算800℃时的平衡常数K=______________。
(3)700℃时,某时刻测得休系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应____________(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)
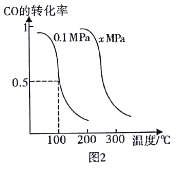
(4)在催化剂作用下,CO可用于合成甲醇CO(g)+2H2(g)=CH3OH(g),若在恒温恒压的条件下,向密闭容器中充入4molol CO和8molH2合成甲醇,平衡时CO的转化率与温度、压强的关系如图2所示。
①该反应的正反应属于_________反应(填“吸热”或“放热”),图2中x_____0.1(填“大于”或“小于”)。
②在0.1 MPa、100℃的条件下,该反应达到平衡时容器内气体的物质的量为_______mol。
③若在恒温恒容的条件下,向上述平衡体系中充入4mol CO、8 mol H2,与原平衡相比,达到平衡时CO的转化率_______(填“增大”,不变”或“减小”,下同),平衡常数K_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在0.2mol/LAlCl3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的( )

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-=Al(OH)3
B.b点水的电离程度小于a点
C.通过曲线变化,可估计Al(OH)3的溶度积约为1×10-20
D.d点时,溶液中已无沉淀剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:

(1)“550℃焙烧”的目的是_____________________________。
(2)“浸出液”的主要成分是__________________。
(3)“钴浸出”过程中Co3+转化为Co2+,该反应的离子方程式为_________________________。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是__________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-6mol/L,则滤液中c(Mg2+)为__________________。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵溶液,再用过量稀硫酸酸化,用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液24.00mL,则草酸钴样品的纯度为___________。
(7)取一定质量的CoC2O4·2H2O分解后的钴氧化物(Co的化合价为+2、+3),用480ml 5mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com