
【题目】常温下,![]() ,
,![]() ,
,![]() ,下列说法正确的是
,下列说法正确的是
A. ![]() 与
与![]() 等体积混合后的溶液中:
等体积混合后的溶液中:![]()
B. 用相同浓度的![]() 溶液分别滴定等体积pH均为3的HCOOH和
溶液分别滴定等体积pH均为3的HCOOH和![]() 溶液至终点,消耗
溶液至终点,消耗![]() 溶液的体积相等
溶液的体积相等
C. ![]() 与
与![]() 盐酸等体积混合后的溶液中
盐酸等体积混合后的溶液中![]() :
: ![]()
D. 浓度均为![]() 的
的![]() 和
和![]() 溶液中阳离子的物质的量浓度之和: 前者小于后者
溶液中阳离子的物质的量浓度之和: 前者小于后者
【答案】C
【解析】首先由三种物质的K值可知,HCOOH、CH3COOH、NH3·H2O都是弱电解质,且酸性HCOOH﹥CH3COOH。NH3﹒H2O的电离程度小于HCOOH。A、二者等体积混合反应生成的HCOONa与没有反应的HCOOH物质的量之比为1:1,且HCOOH是一种弱酸,根据电荷守恒的c(H+)+C(Na+)=c(OH-)+c(HCOO-),溶液中的Na+与HCOO(原子团)物质的量之比为1:2,既2c(Na+)=c(HCOO-)+c(HCOOH),代入约去Na+得2c(H+)+ c(HCOOH)=2c(OH-)+2c(HCOO-),A错误。B、因为HCOOH酸性比CH3COOH强,所以HCOOH的电离程度比CH3COOH大, pH值相等的两种溶液中c(H+)相等,所以CH3COOH溶液浓度比HCOOH溶液浓度大,体积相等时,n(CH3COOH) ﹥n(HCOOH),因此CH3COOH中和消耗的NaOH更多,B错误。C、等体积混合后得到的溶液中NaCl、CH3COOH、CH3COONa浓度相等,因为溶液呈酸性,所以CH3COONa的水解可以忽略不计,溶液中由于CH3COOH的部分电离使溶液呈酸性,所以c(Cl-)﹥c(CH3COOH) ﹥c(H+)。c(Cl-)=c(NaCl)=c(CH 3COONa)=c(CH3COO-)1,溶液中c(CH3COO-)等于c(CH3COO-)1加上CH3COOH电离得到的c(CH3COO-)2,所以c(CH3COO-)﹥c(Cl-),C正确。D、0.1mol/L的HCOONa溶液中阳离子的物质的量浓度之和等于c(Na+)+c(H+)1=c(HCOO-)+c(OH-)1,0.1mol/L的NH4Cl溶液中阳离子的物质的量浓度之和等于c(NH4+)+c(H+)2=c(Cl-)+c(OH-)2,且c(Na+)=c(Cl -)。因为NH3·H2O的电离程度小于HCOOH,所以HCOONa水解程度小于NH4Cl,则c(OH-)1<c(H+)2,温度相同时(常温)KW相等,则c(H+)1﹥c(OH-)2,所以c(Na+)+c(H+)1﹥c(Cl-)+c(OH-)2 =c(NH4+)+c(H+)2,所以D错误。正确答案C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示,不正确的是( )
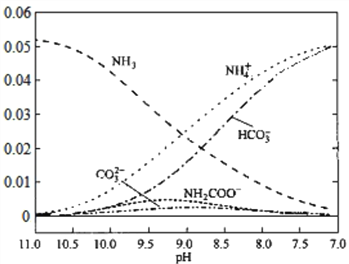
A. 在pH=9.0时,c(NH4+)>c(HCO3ˉ)>c(NH2COOˉ)>c(CO32-)
B. 在氨-水体系中不断通入CO2,体系中始终存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3ˉ)+c(OHˉ)
C. 随着CO2的通入,![]() 不断减小
不断减小
D. pH=7时,水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 mol氩气在标准状况下的体积约为11.2 L
B. 20 ℃、10 MPa状态下,32 g O2和O3的混合气体所含原子数为2.5NA
C. 标准状况下,11.2 L H2CO3含有的原子数为3NA
D. 常温常压下,44 g CO2含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是你,化学是我”.化学与生产、生活密切相关,下列说法错误的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C. 开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D. 二氧化硫有漂白性,常用于棉、麻、纸张和食品的漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下列各图所示是中学化学中常用于混合物分离和提纯的装置:
A. 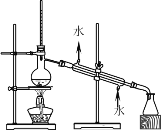 B.
B. 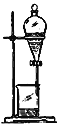
C.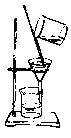 D.
D. 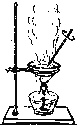
请根据装置图回答下列问题:
⑴A图中用于盛放液体混合物的仪器的名称为:__________________
⑵选择合适的实验装置分离以下混合物(填代表装置的字母),
①从碘水中分离出I2 : ___________
②进行酒精和水的分离: ___________
③二氧化锰和蔗糖溶液: ___________
⑶我国具有历史悠久的酒文化,请回答下列问题:
①要提高酒精的度数,可采用的方法是________________(填操作方法,下同)
②中药常常浸泡在美酒中制成药酒,你认为利用的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。 I.已知:氧化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C 元素的非金属性强弱:____________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是_______________________________。
II.工业制备硫代硫酸钠的反应原理为2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如下图所示装置制备Na2S2O3。
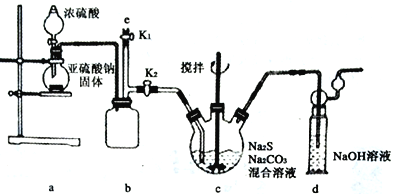
(1)实验中要控制SO2 生成速率,可采取的措施有_______________________(写出一条)。
(2)b装置的作用是____________________________________。
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为___________(填化学式)。
(4)实验结束后,在e处最好连接盛_________(填“NaOH 溶液”、“水”、“CCl4” 中一种)的注射器,接下来的操作为关闭K2 打开K1,最后拆除装置。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取200.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,
用1.00×10-4mol/L 的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定终点的现象:________________________________________。
(6)处理后的废水是否达到排放标准:_______________________________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。NO3-的立体构型的名称为_______________,N原子的杂化方式为________________。NO3-的一种等电子体为________________________。
Ⅱ.CuCl是较为常见的十1价铜的化合物。
(3)基态Cu+的价层电子排布式为________________________。
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心, Cu原子位于Cl原子构成的四面体体心。每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
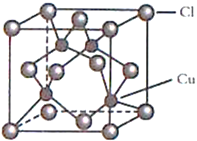 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仔细分析下列实验:
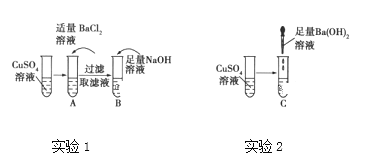
A、B、C试管中的现象如表所示:
试管 | A | B | C |
现象 | 产生白色沉淀, 溶液仍为蓝色 | 产生蓝色沉淀, 溶液变为无色 | 产生蓝色沉淀, 溶液变为无色 |
写出A、B、C试管中所发生反应的离子方程式。
(1)A:______________________________________________。
(2)B:______________________________________________。
(3)C:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com