
【题目】唐山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
SO2(g)+NH3·H2O(aq)![]() NH4HSO3(aq) ΔH1=a kJ·mol1;
NH4HSO3(aq) ΔH1=a kJ·mol1;
NH3·H2O(aq)+ NH4HSO3(aq)![]() (NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
(NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
2(NH4)2SO3(aq)+O2(g)![]() 2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) ![]() 2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
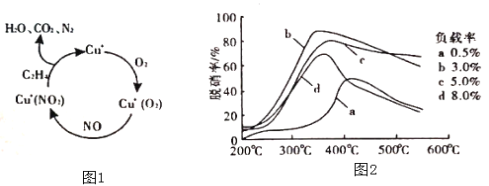
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1,则总反应的化学方程式为_______;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是______。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①T1温度时k正/k逆=__________ L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__________T1(填“>”、“<”或“=")。
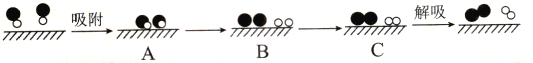
(4)已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
(5)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
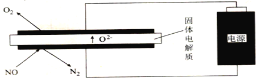
①阴极的电极反应式为______。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)_________。
【答案】2a+2b+c 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O 350℃左右、负载率3.0% 160 > C 2NO+4e-=N2+2O2- 阴极发生副反应O2+4e-=2O2-
3N2+4CO2+4H2O 350℃左右、负载率3.0% 160 > C 2NO+4e-=N2+2O2- 阴极发生副反应O2+4e-=2O2-
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得相应反应的热化学方程式;
(2)由图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O, 据此写出反应的总方程式;根据图2可知,为达到最佳脱硝效果,应满足脱硝率高,负载率低,适宜的温度;
(3)①根据k正/k逆=c2(NO2)/c2(NO)·c(O2)=K,依据表格数据列出三段式求出结论;
②k正=k逆时,则K=1,利用K与温度的关系作答;
(4)该分解反应为放热反应;
(5)①阴极是NO得到电子生成O2-和N2;
②电解装置中下电极板上存在有O2,容易在阴极发生副反应;
(1)根据盖斯定律,将①×2+②×2+③可得2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(1) 的△H=(2a+2b+c)kJ/mol;
(2)①根据图1可以知道,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为: 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O;由图可知,b曲线的最高点处,脱硝率高,负载率低,温度适宜,适宜适合条件为350℃、负载率3.0%;
3N2+4CO2+4H2O;由图可知,b曲线的最高点处,脱硝率高,负载率低,温度适宜,适宜适合条件为350℃、负载率3.0%;
(3)①根据v正=v(NO)消耗=2v(O2)消耗= k正c2(NO)·c(O2),得出k正=v(NO)消耗/c2(NO)·c(O2),根据v逆=v(NO2)消耗= k逆c2(NO2),得出k逆= v(NO2)消耗/c2(NO2),因为v(NO)消耗= v(NO2)消耗,所以k正/k逆= c2(NO2)/ [c2(NO)·c(O2)]=K,表格中初始物质的量:n(NO)=1mol,n(O2)=0.6mol,体积为2L,则列出三段式如下:
2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
起(mol·L-1) 0.5 0.3 0
转(mol·L-1) 0.4 0.2 0.4
平(mol·L-1) 0.1 0.1 0.4
K= c2(NO2)/[c2(NO)·c(O2)]= (0.4mol/L)2/[(0.1 mol
②若将容器的温度改变为T2时其k正=k逆,则K=1<160,因反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0,反应放热,K值减小,则对应的温度增大,即T2>T1;
2NO2(g) △H<0,反应放热,K值减小,则对应的温度增大,即T2>T1;
(4)A→B是NO断键转化为氮原子和氧原子,B→C是氮原子与氮原子结合转化为氮气,氧原子与氧原子结合转化为氧气,断键吸热,成键放热,故能量最低的状态是C处;
(5)①阴极是NO得到电子生成O2-和N2,其电极反应式为:2NO +4e-== N2↑+ 2O2-;
②因O2浓度约为NO浓度的十倍,且电解装置中下电极板上存在有O2,容易在阴极发生副反应:O2+4e-==2O2-,导致耗能远高于理论值。


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】固体X只可能由A1、(NH4)2SO4 ,MgCl2.FeCl2, AlCl3中的一种或几种组成,某同学对该固体进行了如下实验

下列判断正确的是
A.气体甲一定是纯净物B.固体X中一定不存在FeCl2
C.白色沉淀甲可能是混合物D.固体X中一定存在AlCl3、(NH4)2SO4, MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
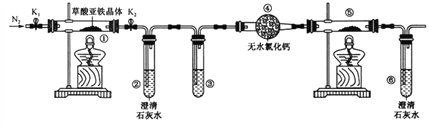
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
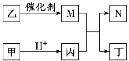
A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N与乙烯均能使溴水褪色,且原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
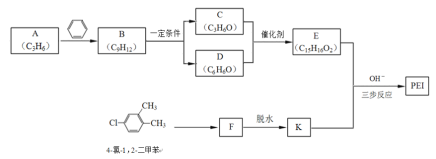
【题目】PEI[![]() ]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):已知:
]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):已知:
i. ![]()
ii.CH3COOH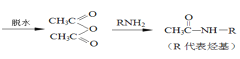 + CH3COOH
+ CH3COOH
(1)A为链状烃。A的化学名称为______。
(2)A→B的反应类型为______。
(3)下列关于D的说法中正确的是______(填字母)。
a.不存在碳碳双键 b.可作聚合物的单体 c.常温下能与水混溶
(4)F由4-氯-1,2-二甲苯催化氧化制得。F所含官能团有-Cl和______。
(5)C的核磁共振氢谱中,只有一个吸收峰。仅以2-溴丙烷为有机原料,选用必要的无机试剂也能合成C。写出有关化学方程式:_____
(6)以E和K为原料合成PEI分为三步反应。
![]()
写出中间产物2的结构简式: _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图。

(1)步骤①中除去粗盐中杂质(Mg2+、SO![]() 、Ca2+),加入的药品顺序正确的是__________。
、Ca2+),加入的药品顺序正确的是__________。
A. NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C. NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D. BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
(2)步骤⑤中已获得Br2,步骤⑥中又用SO2的水溶液将Br2吸收,其目的是___________。
(3)写出步骤⑥中发生反应的离子方程式:_______________。
(4)把溴吹入到SO2的水溶液的气体X最可能用下面的___(填序号)。
A. 乙烯 B. 空气 C. 氩气 D. CO2
(5)由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由弱到强的顺序是___________。
(6)钛是航空、军工、电力等方面的必需原料。常温下钛不与非金属、强酸反应,红热时,却可与常见的非金属单质反应。目前大规模生产钛的方法是:TiO2、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体。该反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,具有十分巨大的开发潜力。工业上从海水中提取镁的流程如下:

下列说法中正确的是
A. 工业上使Mg2+沉淀,试剂①应选用NaOH
B. 将MgCl2溶液直接蒸干得到无水MgCl2
C. 电解MgCl2溶液在阴极得到金属Mg
D. 要使MgSO4完全转化为沉淀,加入试剂①的应过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com