
【题目】海洋约占地球表面积的71%,具有十分巨大的开发潜力。工业上从海水中提取镁的流程如下:

下列说法中正确的是
A. 工业上使Mg2+沉淀,试剂①应选用NaOH
B. 将MgCl2溶液直接蒸干得到无水MgCl2
C. 电解MgCl2溶液在阴极得到金属Mg
D. 要使MgSO4完全转化为沉淀,加入试剂①的应过量
科目:高中化学 来源: 题型:
【题目】唐山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
SO2(g)+NH3·H2O(aq)![]() NH4HSO3(aq) ΔH1=a kJ·mol1;
NH4HSO3(aq) ΔH1=a kJ·mol1;
NH3·H2O(aq)+ NH4HSO3(aq)![]() (NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
(NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
2(NH4)2SO3(aq)+O2(g)![]() 2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) ![]() 2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
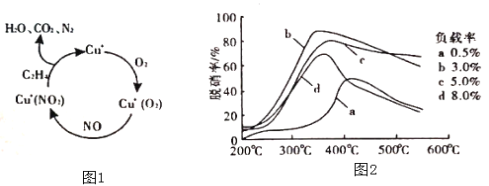
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1,则总反应的化学方程式为_______;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是______。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①T1温度时k正/k逆=__________ L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__________T1(填“>”、“<”或“=")。
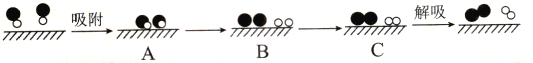
(4)已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
(5)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
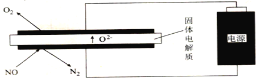
①阴极的电极反应式为______。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对含硼(元素符号为“B”)物质结构的研究,极大地推动了结构化学的发展。回答下列问题:
(1)基态B原子价层电子的电子排布式为_____,核外电子占据最高能层的符号是____,占据该能层未成对电子的电子云轮廓图形状为____。
(2)1923年化学家Lewis提出了酸碱电子理论。酸碱电子理论认为:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。已知BF3与F-反应可生成BF4-,则该反应中BF3属于____(填“酸”或“碱”),原因是____。
(3)NaBH4是有机合成中常用的还原剂,NaBH4中的阴离子空间构型是_____,中心原子的杂化形式为____,NaBH4中存在____(填标号)
a.离子键 b.金属键 c.σ键 d.π键 e.氢键
(4)请比较第一电离能:IB____IBe(填“>”或“<”),原因是_______。
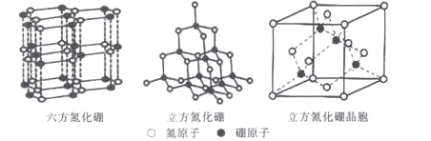
(5)六方氮化硼的结构与石墨类似,B—N共价单键的键长理论值为158pm,而六方氮化硼层内B、N原子间距的实测值为145 pm,造成这一差值的原因是____。高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,已知晶胞参数中边长为a=362 pm,则立方氮化硼的密度是____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)写出溶解过程中发生的氧化还原反应的离子方程式:_________
(2)还原过程中发生的主要反应的离子方程式:_________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是__________。
(4)写出氯化亚铜在空气中被氧化的化学方程式________
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是___。

(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1mol P4S3分子中含有9mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
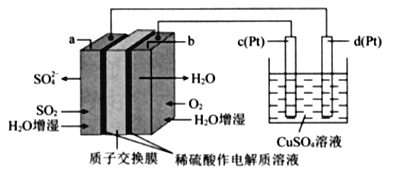
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3 和+6 价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知 Na2Cr2O7 是一种强氧化剂),其主要工艺流程如下:

查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________。
(2)酸化滤液D时,不选用盐酸的原因是_____________。
(3)固体E的主要成分是Na2SO4,根据如图分析操作a为________________、____________、洗涤、干燥。
(4)已知含+6 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。
![]()
①Cr(OH)3的化学性质与 Al(OH)3相似。在上述生产过程中加入NaOH 溶液时要控制溶液的pH不能过高,是因为__________________________(用离子方程式表示);
②下列溶液中可以代替上述流程中Na2S2O3溶液最佳的是___________(填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1 mol Na2S2O3 转移0.8 mole-,则加入Na2S2O3溶液时发生反应的离子方程式为__________________________________。
(5)某厂废水中含1.00×103 mol/L的Cr2O72-,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Cr 的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的 Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________gFeSO47H2O。
(已知FeSO47H2O摩尔质量为278g/mol)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。


(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I的反应速率v(I)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 molL-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com