
【题目】人们对含硼(元素符号为“B”)物质结构的研究,极大地推动了结构化学的发展。回答下列问题:
(1)基态B原子价层电子的电子排布式为_____,核外电子占据最高能层的符号是____,占据该能层未成对电子的电子云轮廓图形状为____。
(2)1923年化学家Lewis提出了酸碱电子理论。酸碱电子理论认为:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。已知BF3与F-反应可生成BF4-,则该反应中BF3属于____(填“酸”或“碱”),原因是____。
(3)NaBH4是有机合成中常用的还原剂,NaBH4中的阴离子空间构型是_____,中心原子的杂化形式为____,NaBH4中存在____(填标号)
a.离子键 b.金属键 c.σ键 d.π键 e.氢键
(4)请比较第一电离能:IB____IBe(填“>”或“<”),原因是_______。
(5)六方氮化硼的结构与石墨类似,B—N共价单键的键长理论值为158pm,而六方氮化硼层内B、N原子间距的实测值为145 pm,造成这一差值的原因是____。高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,已知晶胞参数中边长为a=362 pm,则立方氮化硼的密度是____g/cm3。
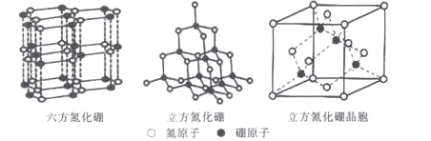
【答案】2s22p1 L 哑铃形(或纺锤形) 酸 BF3中B采用sp2杂化,未参与杂化的2p空轨道接受F-的一对孤电子,形成配位键,因此BF3属于酸 正四面体 sp3 ac < Be原子的2s为全充满结构,较为稳定 层内B、N原子间形成了π键 ![]()
【解析】
(1)B为5号元素,据此书写B原子价层电子的电子排布式;
(2)B原子最外层含有3个电子,与3个F形成3个共用电子对,还存在1个空轨道,据此分析判断;
(3)根据价层电子对个数=σ键个数+孤电子对个数=σ键个数+![]() (a-xb)计算判断;
(a-xb)计算判断;
(4)Be原子的2s为全充满结构,较为稳定,据此分析判断;
(5)六方氮化硼的结构与石墨类似,层内B、N原子间形成了π键;根据晶胞结构图,利用均摊法计算一个晶胞中含有的白球数和黑球数,再确定一个晶胞的质量和体积,最后根据ρ=![]() 计算。
计算。
(1)B为5号元素,基态B原子价层电子的电子排布式为2s22p1,核外电子占据最高能层的符号为L,占据该能层未成对电子的为2p,电子云轮廓图为哑铃形(或纺锤形),故答案为:2s22p1;L;哑铃形(或纺锤形);
(2)根据酸碱电子理论:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。BF3中B采用sp2杂化,未参与杂化的2p空轨道接受F-的一对孤电子,形成配位键,因此BF3属于酸,故答案为:酸;BF3中B采用sp2杂化,未参与杂化的2p空轨道接受F-的一对孤电子,形成配位键,因此BF3属于酸;
(3)BH4-中B原子孤电子对数=![]() =0,价层电子对数=4+0=4,VSEPR模型为正四面体,没有孤电子对,空间构型为正四面体,B原子杂化方式为sp3,Na+、BH4-离子之间形成离子键,BH4-中B原子与H原子之间形成共价键和配位键,均属于σ键,故答案为:正四面体;sp3;ac;
=0,价层电子对数=4+0=4,VSEPR模型为正四面体,没有孤电子对,空间构型为正四面体,B原子杂化方式为sp3,Na+、BH4-离子之间形成离子键,BH4-中B原子与H原子之间形成共价键和配位键,均属于σ键,故答案为:正四面体;sp3;ac;
(4)Be原子的2s为全充满结构,较为稳定,使得第一电离能大于B第一电离能,故答案为:<;Be原子的2s为全充满结构,较为稳定;
(5)六方氮化硼的结构与石墨类似,层内B、N原子间形成了π键,使得B—N共价单键的键长变短;根据晶胞结构图,一个晶胞中含有的白球数=8×![]() +6×
+6×![]() =4,黑球数=4,因此立方氮化硼晶胞中应该含有4个N和4个B原子,一个晶胞的质量为
=4,黑球数=4,因此立方氮化硼晶胞中应该含有4个N和4个B原子,一个晶胞的质量为![]() ,一个立方氮化硼晶胞的体积是(362pm)3,根据ρ=
,一个立方氮化硼晶胞的体积是(362pm)3,根据ρ=![]() =
=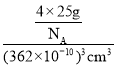 =
=![]() g/cm3,故答案为:层内B、N原子间形成了π键;
g/cm3,故答案为:层内B、N原子间形成了π键;![]() 。
。


科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
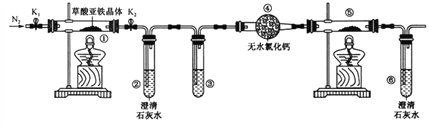
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述正确的是( )
A.次氯酸的电子式:![]()
B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(1)△H=-57.3kJmol
C.H2S电离的方程式为:H2S![]() 2H++S2-
2H++S2-
D.标准状况下,1.12L![]() 和1.12L
和1.12L ![]() ,均含有0.1NA个氧原子
,均含有0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只由非极性键构成的物质是___(填编号,下同);
(2)由离子键和极性键构成的物质是___;
(3)属于共价化合物的物质是___;
(4)⑤H2O2的电子式为:___;
(5)用电子式表示⑥MgF2的形成过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯的透光率良好,可制作挡风玻璃、眼镜片等。某聚碳酸酯(M)的合成路线如下:
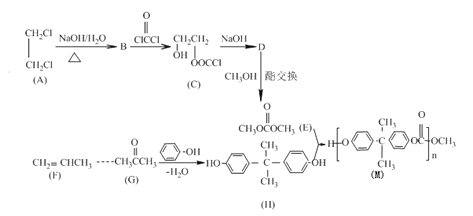
已知:
Ⅰ.D的分子式为C3H4O3,核磁共振氢谱只有一组峰
Ⅱ.R1COOR2+R3OH![]() R1COOR3+ R2OH
R1COOR3+ R2OH
(1)A的名称是 _______,D的结构简式为_____;
(2)B→C的反应类型______;
(3)关于H的说法正确的是(_______)
A.分子式为C15H16O2
B.呈弱酸性,是苯酚的同系物
C.分子中碳原子可能共面
D.1mol H与浓溴水取代所得有机物最多消耗NaOH10mol
(4)写出A→B化学方程式________;
(5)最常见的聚碳酸酯是用H与光气(![]() )聚合得到,请写出该聚碳酸酯的结构简式________;
)聚合得到,请写出该聚碳酸酯的结构简式________;
(6)H的同分异构体中满足下列条件的有___种;
①有萘环(![]() )结构 ②能发生水解和银镜反应 ③两个乙基且在一个环上
)结构 ②能发生水解和银镜反应 ③两个乙基且在一个环上
(7)F→G需三步合成
CH2=CHCH3![]() K
K![]() L
L
若试剂1为HBr,则L的结构简式为_______,③的反应条件是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,具有十分巨大的开发潜力。工业上从海水中提取镁的流程如下:

下列说法中正确的是
A. 工业上使Mg2+沉淀,试剂①应选用NaOH
B. 将MgCl2溶液直接蒸干得到无水MgCl2
C. 电解MgCl2溶液在阴极得到金属Mg
D. 要使MgSO4完全转化为沉淀,加入试剂①的应过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以海水为原料可以提取金属镁,下图是某工厂从海水中提取镁的主要步骤。讨论以下相关问题

(1)在海水提镁的过程中如何实现对镁离子的富集,有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
通过分析比较你认为学生_____的观点正确(填学生序号)。
(2)为了使镁离子沉淀下来,充分利用当地的贝壳(主要成分为碳酸钙)资源获得沉淀剂,加入的试剂①是_________(填化学式)。写出由贝壳制取试剂①的相关化学方程式:___________;
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_________(填标号字母)
A.蒸馏 B.分液 C.过滤 D.萃取
(4)加入的试剂②是________(填化学式)。工业过程中常常将蒸发结晶后的氯化镁水合物晶体再置于HCl气流中加热获得无水MgCl2,其目的是______________________________。
(5)写出由无水MgCl2制取金属镁的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B |
装 置 图 |
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 |
选项 | C | D |
装 置 图 |
|
|
现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com