
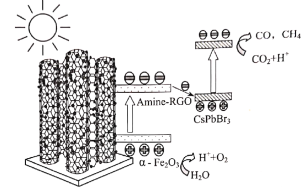
【题目】中山大学化学科研团队首次将CsPbBr3纳米晶锚定在氨基化RGO包覆的α—Fe2O3(α—Fe2O3/Amine—RGO/CsPbBr3),构筑Z—Scheme异质结光催化剂,可有效降低电荷复合,促进电荷分离,从而提升光催化性能。光催化还原CO2和氧化H2O的反应路径如图。下列说法正确的是( )
A.该路径能量转化形式为电能→化学能
B.该光催化转化反应可以阻止温室效应
C.“CsPbBr3纳米晶”表面发生了还原反应
D.该催化转化的总反应涉及到非极性共价键、极性共价键的断裂和形成
【答案】C
【解析】
H2O能在![]() 光催化剂材料作用下,被氧化成O2,同时生成质子(H+),发生的氧化反应为:
光催化剂材料作用下,被氧化成O2,同时生成质子(H+),发生的氧化反应为:![]() ;电子转移到“CsPbBr3纳米晶”用于还原CO2,CO2被还原为CO、CH4,发生的还原反应为:CO2+2e-+2H+=CO+H2O、CO2+8e-+8H+=CH4+2H2O。
;电子转移到“CsPbBr3纳米晶”用于还原CO2,CO2被还原为CO、CH4,发生的还原反应为:CO2+2e-+2H+=CO+H2O、CO2+8e-+8H+=CH4+2H2O。
A.由图可知,光能使![]() 光催化剂材料产生电子,电子的移动引起电极上发生氧化还原反应,最终生成O2、CO、CH4,储存能量,该路径能量转化形式为光能→电能→化学能,A错误;
光催化剂材料产生电子,电子的移动引起电极上发生氧化还原反应,最终生成O2、CO、CH4,储存能量,该路径能量转化形式为光能→电能→化学能,A错误;
B. 该光催化转化反应生成了CH4,CH4也能导致温室效应,故该反应不能阻止温室效应,B错误;
C. “CsPbBr3纳米晶”表面上CO2转化为CO、CH4,发生了还原反应:CO2+2e-+2H+=CO+H2O、CO2+8e-+8H+=CH4+2H2O,C正确;
D. 该催化转化的总反应:2CO2![]() 2CO+O2、CO2+2H2O
2CO+O2、CO2+2H2O![]() CH4+2O2,CO2、H2O都只含有极性共价键,CO、CH4都只含极性共价键,O2只含非极性共价键,故只有极性共价键断裂、有极性和非极性共价键生成,D错误;
CH4+2O2,CO2、H2O都只含有极性共价键,CO、CH4都只含极性共价键,O2只含非极性共价键,故只有极性共价键断裂、有极性和非极性共价键生成,D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
A. 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C. NaCN中通入少量CO2发生的化学反应为:NaCN+CO2+H2O=HCN+NaHCO3
D. 稀释HCN溶液过程中,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3mol A与3mol B混合于3L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+nD(g),2s后达平衡A的转化率为50%,测得v(D)=0.25molL-1s-1,下列推断正确的是( )
2C(g)+nD(g),2s后达平衡A的转化率为50%,测得v(D)=0.25molL-1s-1,下列推断正确的是( )
A.v(B)=0.25molL-1s-1B.C的体积分数为30%
C.B的转化率为25%D.n=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些共价键的键能数据如表(单位:kJmol-1):
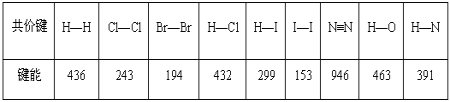
(1)把1mol Cl2分解为气态原子时,需要___(填“吸收”或“放出”)243kJ能量。
(2)由表中所列化学键形成的单质分子中,最稳定的是___;形成的化合物分子中最不稳定的是___。
(3)发射火箭时用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭气化作为洁净煤利用的核心技术,是影响煤化工系统效率、污染物及温室气体排放的关键。工业生产中主要的气化方式包括纯水气化、CO2气化和纯氧气化,反应如下:
i.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+119kJ·mol-1
CO(g)+H2(g) ΔH=+119kJ·mol-1
ii.C(s)+CO2(g)![]() 2CO(g) ΔH=+162kJ·mol-1
2CO(g) ΔH=+162kJ·mol-1
iii.C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-123kJ·mol-1
CO(g) ΔH=-123kJ·mol-1
iv.C(s)+ O2(g)![]() CO2(g) ΔH=-409kJ·mol-1
CO2(g) ΔH=-409kJ·mol-1
(1)均相水煤气反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的ΔH__。
H2(g)+CO2(g)的ΔH__。
(2)图1是不同气化方式得到的合成气成分,图2是温度对碳转化率的影响(碳转化率是指气化得到气体中的碳占入炉原料煤中碳的质量分数)。
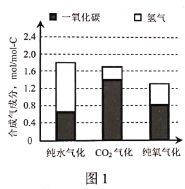
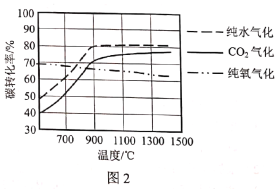
①气化过程中不同氧化剂的配比会对合成气的成分造成很大影响,为了提高合成气的氢碳比,生产中应该适当提高__在氧化剂中的比例。
②若使用混合氧化剂进行气化,最佳气化温度是___℃。温度升高纯氧气化的碳转化率降低,原因是___。
③工业上常在压强200kPa的条件下进行气化,压强过高过低都不利于气化的进行,可能的原因是__。
④T℃时,向容积可变的恒压密闭容器中加入20g燃煤(含碳84%)和2molH2O(g)模拟纯水气化反应,起始容积为2L。一段时间达到平衡后,测得容器内H2为1mol。则该温度下C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数K=__。
CO(g)+H2(g)的平衡常数K=__。
(3)煤的气化中可以利用CO2捕集技术实现CO2的综合利用。用石墨电极电解CO2制CH3CH2OH的原理示意图如图:
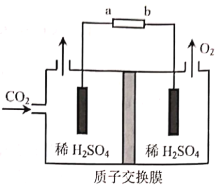
①b为电源的___(填“正”或“负”)极。
②生成CH3CH2OH的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】84消毒液、酒精、过氧乙酸等消毒剂在抗击新型冠状病毒肺炎疫情中起到重要作用。回答下列问题:
Ⅰ.84消毒液是北京第一传染病医院(现北京地坛医院)于1984年研制的一种消毒液,主要成分为受热易分解的次氯酸钠(NaClO)。某实验小组用如图装置制备84消毒液。
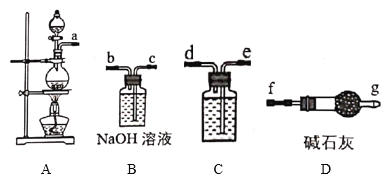
(1)A中发生反应的离子方程式为___。
(2)C中盛装试剂为__,仪器的连接顺序为a→__。
(3)制备84消毒液时,若Cl2与NaOH溶液反应温度过高,NaClO的产率将__(填“增大”“减小”或“不变”)。
Ⅱ.过氧乙酸(CH3COOOH)是无色液体,易溶于水,有强烈刺激性气味,有腐蚀性,对人的眼睛、皮肤、黏膜、上呼吸道等有强烈刺激作用,易分解,易爆炸。
(4)贮存和运输CH3COOOH时要注意的事项是__。
(5)消毒过程中需将200mL20%的过氧乙酸(密度为1.02g·cm-3)稀释为0.5%的过氧乙酸,则需加入水的体积为__![]() 。
。
(6)CH3COOOH可用H2O2和CH3COOH制备,其化学方程式为___。
(7)制备CH3COOOH过程中总会残留少量H2O2,因此CH3COOOH在使用过程中需要准确标定原液的浓度。取CH3COOOH样品![]() ,标定步骤如下:
,标定步骤如下:
a.用KMnO4标准溶液滴定H2O2;
b.当达到终点时加入足量KI溶液,发生反应:2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
c.用1.500mol·L-1Na2S2O3标准溶液滴定生成的I2,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液20.00mL。
测得样品中CH3COOOH的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
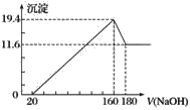
(1)合金中镁的质量是__________。
(2)所用盐酸的物质的量浓度是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、![]() 、Cl-中的一种或几种,为鉴别其中所含离子,现进行如下实验:
、Cl-中的一种或几种,为鉴别其中所含离子,现进行如下实验:

请回答下列问题:
(1)原溶液中一定存在的离子是______(填离子符号,下同),一定不存在的离子是______________,可能存在的离子是__________________。
(2)为进一步确定原溶液中可能存在的离子是否存在,应进行的实验操作及判断依据是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com