
【题目】某些共价键的键能数据如表(单位:kJmol-1):
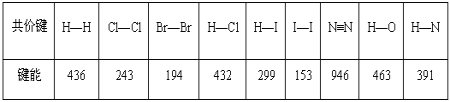
(1)把1mol Cl2分解为气态原子时,需要___(填“吸收”或“放出”)243kJ能量。
(2)由表中所列化学键形成的单质分子中,最稳定的是___;形成的化合物分子中最不稳定的是___。
(3)发射火箭时用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:____。
【答案】吸收 N2 HI 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g) △H=﹣1136kJmol﹣1
【解析】
(1)化学键断裂要吸收能量;
(2)键能越大越稳定,否则越不稳定,结合表中数据分析;
(3)根据n=![]() 计算32g N2H4的物质的量,再根据热化学方程式书写原则书写热化学方程式。
计算32g N2H4的物质的量,再根据热化学方程式书写原则书写热化学方程式。
(1)化学键断裂要吸收能量,由表中数据可知把1mol Cl2分解为气态原子时,需要吸收243kJ的能量;
(2)因键能越大越稳定,单质中最稳定的是H2,最不稳定的是I2,形成的化合物分子中,最稳定的是HCl,最不稳定的是HI;
(3)32g N2H4(g)的物质的量为![]() =1mol,与二氧化氮反应生成氮气与气态水放出568kJ的热量,热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g) △H=-1136kJmol-1。
=1mol,与二氧化氮反应生成氮气与气态水放出568kJ的热量,热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g) △H=-1136kJmol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
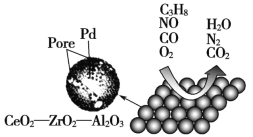
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
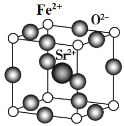
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰化钾(KSCN)是中学实验室的常见药品,某校化学兴趣小组在实验室制备少量样品,并进行探究实验。他们查有关资料:CS2+2NH3![]() NH4SCN+H2S,该反应比较缓慢。
NH4SCN+H2S,该反应比较缓慢。
Ⅰ.制备KSCN样品。
(1)先制备NH4SCN溶液,装置如图:
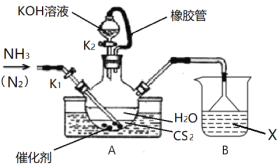
①实验开始时打开K1,关闭K2,加热水浴装置,缓缓地向三颈烧瓶中持续通入NH3,并持续通入N2,通入N2的作用是:____________。
②一段时间后,当CS2反应完毕,停止实验,此时可以观察到三颈烧瓶内的现象是:______。
③烧杯内的溶液X是______________。
(2)再制备KSCN溶液:关闭K1,打开K2,利用耐碱分液漏斗缓慢加入适量KOH溶液,继续加热,此时三颈烧瓶中发生反应的化学方程式是____________________。
(3)样品检测:待冷却后,用胶头滴管吸取少量样品滴入试管中的FeCl3溶液中,并没有观察到明显变红的现象,请分析可能的原因:_____________。
Ⅱ.KSCN的探究实验,同学们用实验室配制的KSCN溶液做下列实验(不是刚才兴趣小组合成的)。
(4)同学甲想检测Fe3O4中是否有三价铁,他把在充满氧气的集气瓶中燃烧后的铁丝残渣放入试管,加适量盐酸使其溶解,再往混合液中滴入少量KSCN溶液检验是否有Fe3+,结果没变红,请分析原因:_________________。
(5)同学乙想利用反应Fe3++3SCN-Fe(SCN)3来研究浓度对化学平衡的影响。他往盛有5 mL 0.05 mol/L FeCl3溶液的试管中加入5 mL_____ mol/L KSCN溶液,再把反应后的溶液均分置于两只试管中,分别加4滴浓FeCl3溶液和4滴浓KSCN溶液,观察现象并得出有关结论。
(6)同学丙往FeCl2和KSCN的混合溶液中滴加氯水,溶液变成红色,不过他注意到,当氯水过量时,红色会褪去,为此,他设计如图装置进行探究。
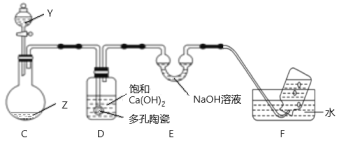
Y为NaClO溶液,Z为FeCl3和KSCN的混合溶液。打开分液漏斗,持续缓慢滴入NaClO溶液至过量,他观察到:C中红色变浅,有大量气泡产生,C中还有现象为:___________________;D中的现象为:_______________,F中有气泡。由此推测,KSCN具有______________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学化学科研团队首次将CsPbBr3纳米晶锚定在氨基化RGO包覆的α—Fe2O3(α—Fe2O3/Amine—RGO/CsPbBr3),构筑Z—Scheme异质结光催化剂,可有效降低电荷复合,促进电荷分离,从而提升光催化性能。光催化还原CO2和氧化H2O的反应路径如图。下列说法正确的是( )
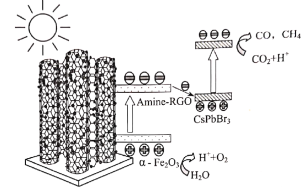
A.该路径能量转化形式为电能→化学能
B.该光催化转化反应可以阻止温室效应
C.“CsPbBr3纳米晶”表面发生了还原反应
D.该催化转化的总反应涉及到非极性共价键、极性共价键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲。电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法不正确的是
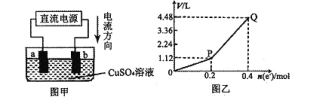
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b电极上发生的反应方程式为:4OH-一4e-=2H2O+O2↑
C.曲线O一P段表示H2的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com