
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
【答案】D
【解析】
定压强相同,比较温度不同时,即比较曲线T1、p2与曲线T2、p2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应;
定温度相同,比较压强不同时,即比较曲线T1、p1与曲线T1、p2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以p1<p2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n<p;
根据以上分析得出:T1>T2,反应吸热;p1<p2,m+n<p;D项正确,
答案选D。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与右图中四种物质发生的反应 (a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )

A.aB.bC.cD.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有以下几种方法:①热分解法;②焦炭法;③水煤气法(CO或H2);④活泼金属置换法;⑤电解法。这几种方法各有优缺点,它们在工业上均有应用。古代有:a.火烧孔雀石炼铜;b.湿法炼铜;现代有:c.铝热法炼铁;d.光卤石法炼镁。对它们的冶炼方法分析不正确的是
A. a用② B. b用③ C. c用④ D. d用⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,图1表示各物质浓度随时间的变化,图2表示速率随时间的变化。t2、t3、t4、t5时刻后各改变一种条件,且改变条件均不同。若t4时刻改变条件是压强,则下列说法错误的是
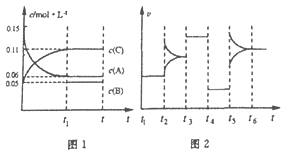
A. 若t1=15s,则前15s的平均反应速率v(C)=0.004mol·L-1·s-1
B. 该反应的化学方程式为:3A(g) ![]() B(g)+2C(g)
B(g)+2C(g)
C. t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D. B的起始物质的量为0.04mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
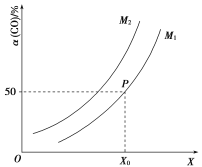
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中不正确的是( )

A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B.钾的焰色实验要透过蓝色钴玻璃观察
C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.没有铂丝可用无锈铁丝代替进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出).
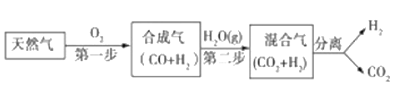
(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),某温度下,将1mol CO2和3mol H2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0. 90 | 0. 85 | 0. 83 | 0. 81 | 0. 80 | 0. 80 |
①用H2表示前2h平均反应速率v(H2)=___.
②该温度下CO2的平衡转化率为___.
(2)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1:3通入一恒压密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92. 4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92. 4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
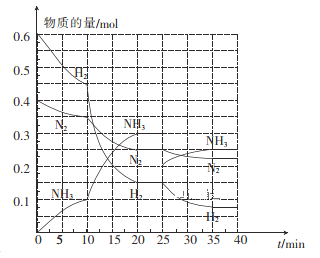
①在10~20 min内,NH3浓度变化的原因可能是_______。
A. 加入催化剂 B. 缩小容器体积 C. 降低温度 D. 增加NH3的物质的量
② 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物的结构表示为![]() ,其名称是________________________。
,其名称是________________________。
(2)写出下列反应的化学方程式:
①草酸能使酸性高锰酸钾溶液褪色:____________________________________。
②把浓硝酸、浓硫酸和甲苯混合加热制备TNT:______________________________。
③溴乙烷在一定条件下发生消去反应:__________________________________。
(3)某烃A分子中碳的质量分数为90.57%,在某温度下V L该烃的蒸气质量是相同状况下V L H2质量的53倍,则烃A的分子式为______________;若烃A分子中含有苯环,且苯环上的一氯代物只有一种,则A的结构简式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com