
【题目】一定条件下向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,图1表示各物质浓度随时间的变化,图2表示速率随时间的变化。t2、t3、t4、t5时刻后各改变一种条件,且改变条件均不同。若t4时刻改变条件是压强,则下列说法错误的是
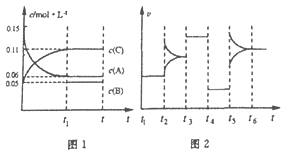
A. 若t1=15s,则前15s的平均反应速率v(C)=0.004mol·L-1·s-1
B. 该反应的化学方程式为:3A(g) ![]() B(g)+2C(g)
B(g)+2C(g)
C. t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D. B的起始物质的量为0.04mol
【答案】C
【解析】
A.若t1=15s,生成物C在t0~t1时间段的平均反应速率v=![]() =
=![]() mol/(Ls)=0.004mol/(Ls),A正确;B.反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)
mol/(Ls)=0.004mol/(Ls),A正确;B.反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)![]() B(g)+2C(g),B正确;C. t2、t3、t5时刻改变的条件分别是增大反应物浓度、加入催化剂、升高温度,C错误;D.根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
B(g)+2C(g),B正确;C. t2、t3、t5时刻改变的条件分别是增大反应物浓度、加入催化剂、升高温度,C错误;D.根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为![]() =2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,D正确。答案选C。
=2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,D正确。答案选C。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】物质中的化学能在一定条件下可转化为电能。
(1)将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式是_________。
(2)将锌片、铜片按照下图所示装置连接,能证明化学能转化为电能的实验现象是:铜片上有气泡产生、_________。
(3)稀硫酸在下图所示装置中的作用是:传导离子、_________。

(4)下列反应通过原电池装置,可实现化学能直接转化为电能的是_________ (填序号)。
①CaCO3+2HCl=CaCl2+H2O+CO2↑
②2H2+O2![]() 2H2O
2H2O
③Pb+PbO2 +2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以上数据,磷原子的半径可能是
原子 | N | S | O | Si |
半径/nm | 0.075 | 0.102 | 0.074 | 0.117 |
A.0.080 nmB.0.110 nmC.0.120 nmD.0.070 nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。
(1)利用硫酸工业废气中的SO2 可以处理酸性含铬废水,用离子方程式表示反应原理___________。
(2)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为__________________。
(3)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的酸式电离方程式__________。
(4)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________。控制其他条件不变,反应温度对Cr3+转化率的影响如下图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,10 L 0.4 mol·L-1 H2O2溶液发生催化分解:2H2O2===2H2O+O2↑,不同时刻测得生成O2的体积如下表,已知反应至6 min时,H2O2分解了50%(已折算为标准状况)
t/min | 0 | 2 | 4 | 6 |
V(O2)/L | 0.0 | 9.9 | 17.2 | V=? |
下列叙述正确的是(溶液体积变化忽略不计)( )
A. 0~2 min H2O2平均反应速率比4~6 min慢
B. 反应至6 min时,共产生O2 44.8 L
C. 0~6 min的平均反应速率v(H2O2)≈3.3×10-2 mol·L-1·min-1
D. 反应至6 min时,c(H2O2)=0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前钴酸锂(LiCoO2)锂离子电池应用十分广泛,从废旧钴酸锂理离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题,某小组模拟工业流程从废旧电池中对上述元素进行提取。
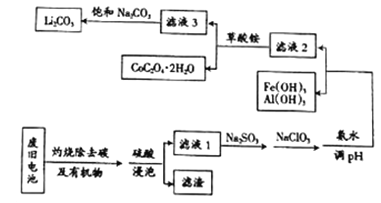
已知:①滤液1中阳离子有H+、CO3+、Fe3+、Al3+、Li+等;
②几种物质不同温度下的溶解度如下表所示:
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)钴酸锂(LiCoO2)中钴元素的化合价是_______________。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为_________________。
(3)滤液1中加入Na2SO3的主要目的是_____________________;加入NaClO3的主要目的是____________。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mol·L-1时表示已沉淀完全)加入氨水调节pH的最小值是____________(保留一位小数)。{已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,lg3=0.52}
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是_________。
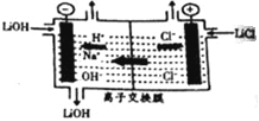
(6)为得到高纯度的Li2CO3,需将粗产品Li2CO3与盐酸反应制得的LiCl进行电解。其原理如图所示:
①电解时阳极的电解反应式为_____________________。
②电解后向产品LiOH溶液中加入过滤NH4HCO3溶液生成Li2CO3,反应的化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com