
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
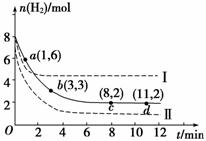
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是________(填序号)。
a.0~1 min b.1~3 min
c.3~8 min d.8~11 min
(2)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________________,曲线Ⅱ改变的条件可能是________________。
(3)下列表述能表示该反应已达平衡的是________(填序号)。
a.容器内压强不再改变
b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变
d.容器内各物质的物质的量相等
解析 (1)图像中的斜率越大,速率越大。
(2)曲线Ⅰ与实线相比较,起点相同,达到平衡所用的时间短,反应速率加快,且平衡时n(H2)大,改变的条件应是升高温度,使平衡左移;曲线Ⅰ与实线相比较,起点相同,达到平衡所用的时间短,反应速率加快,且平衡时n(H2)小,改变的条件应是增大压强,使平衡右移。
(3)反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1是正反应体积缩小的放热反应。容器内压强、气体平均摩尔质量不再改变,说明气体的总物质的量不再改变,a、c符合题意;容器的体积不变,质量不变,密度始终不变,b不符合题意;容器内各物质的物质的量相等,不一定达到平衡,d不符合题意。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1是正反应体积缩小的放热反应。容器内压强、气体平均摩尔质量不再改变,说明气体的总物质的量不再改变,a、c符合题意;容器的体积不变,质量不变,密度始终不变,b不符合题意;容器内各物质的物质的量相等,不一定达到平衡,d不符合题意。
答案 (1)a (2)升高温度 增大压强 (3)a、c


科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol NaHSO4晶体中离子总数为3NA
B.2.24 L 14CH4分子中所含中子数为0.8NA
C.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D. 常温常压下,16gO2和O3混合气体含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是( )
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c(NH4Cl) ﹥c[(NH4)2SO4]﹥c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省
略):
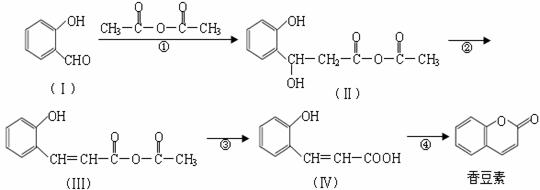
(1)Ⅰ的分子式为_____________;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为______________。
(2)反应②的反应类型是_____________,反应④的反应类型是_____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为
________ 。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能够发生酯化反应和银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下,
 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应2A(s)+3B(g)  C(g)+2D(g) ΔH<0,在一定条件下达到平衡。下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡。下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,v(正)减小 ③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度, v(正)>v(逆) ⑤加入催化剂,B的转化率提高
v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A.①② B.④
C.③ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,向容积为2 L的密闭容器中充入一定量A和足量B,发生反应如下:2A(g)+B(s)2C(g),测得相关数据如下,分析可知下列说法不正确的是
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol·L-1 | 1 | 2 | 1 |
| c(A)平衡/mol·L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
A.实验Ⅲ的化学平衡常数K<1
B.实验放出的热量关系为b=2a
C.实验Ⅲ在30 min达到平衡,30 min内A的速率:v(A)=0.002 5 mol·L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
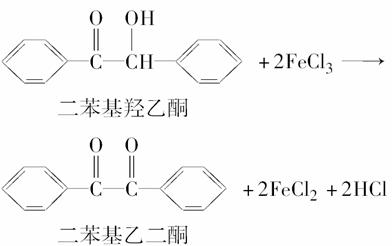

在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:
加热溶解―→活性炭脱色―→趁热过滤―→冷却结晶―→抽滤―→洗涤―→干燥
请回答以下问题:
(1)写出装置图中玻璃仪器的名称:
a____________,b____________。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:________。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用________、______等方法促进晶体析出。
(3)抽滤所用的滤纸应略________(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯
基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是________。
A.无水乙醇 B.饱和氯化钠溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是________。
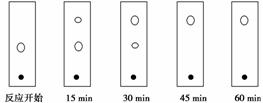
A.15 min B.30 min
C.45 min D.60 min
查看答案和解析>>
科目:高中化学 来源: 题型:
光合作用的反应原理为:6CO2 + 6H2O C6H12O6+6O2
C6H12O6+6O2
1、上述反应中有一种物质属于含有极性键的非极性分子,其电子式为___________,与该分子中心原子同族的短周期元素在周期表中的位置是_____________。
2、上述反应涉及的元素中,原子半径由大到小的顺序是_______________,原子最外层有两个未成对电子的是_____________
3、上述反应涉及的元素中,第二周期两种元素的非金属性的强弱关系为___________,试用一个事实说明你的结论________________________________
4、检验C6H12O6可用___________(填试剂名称),C6H12O6在人体内被氧化而提供能量,某同学认为该反应和光合作用互为可逆反应,对此,你的观点是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com