
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应Na+2H2O=Na++2OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑ | |
| C. | 金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ | |
| D. | 铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中的每个小黑点表示1个电子 | |
| B. | 图乙表示1s电子只能在球体内出现 | |
| C. | 图乙表明1s轨道呈球形,有无数对称轴 | |
| D. | 不同能层的s轨道平均半径都一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图所示的反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热的化学反应不一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
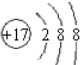 ;
;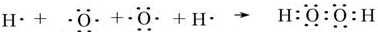 ;
;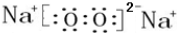 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,lmolH发生该反应转移电子数为6.02×1023或NA;
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,lmolH发生该反应转移电子数为6.02×1023或NA;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
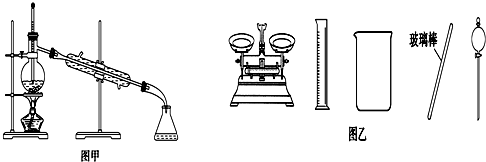
| A. | 可用碱式滴定管量取12.85 mL KMnO4溶液 | |
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol•L-1 NaCl溶液,必要的仪器如图乙所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com