
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f是原子序数依次递增的短周期元素,周期表中b与c、c与d相邻;b与f的最外层电子数之比为2:3,c的最外层电子数比f的最外层电子数少1个;常见化合物e2d2与水反应生成d的单质;a与d两元素只能形成两种化合物,电子数分别为10和18个。
(1)b、c、d氢化物稳定性顺序为(用分子式表示)______<______<______;
(2)由4个a原子、2个c、3个d原子组成化合物Z,则Z中的化学键类型为______;
(3)bc-离子的电子式为____________;
(4)一定量的e2d2与bd2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则该固体物质的组成为_______mol Na2O2、________mol Na2CO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )

A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D. 25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的Cl会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
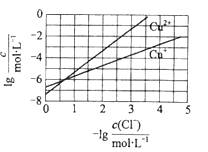
A. Ksp(CuCl)的数量级为![]()
B. 除Cl反应为Cu+Cu2++2Cl![]() 2CuCl
2CuCl
C. 加入Cu越多,Cu+浓度越高,除Cl效果越好
D. 2Cu+![]() Cu2++Cu平衡常数很大,反应趋于完全
Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中生成H2的速率最快的是( )
金属 | 酸溶液 | 温度 | |
A | Mg | 0.5 mol·L-1 H2SO4 | 20℃ |
B | Mg | 1 mol·L-1 H2SO4 | 30℃ |
C | Zn | 2 mol·L-1 HCl | 20℃ |
D | Fe | 1 mol·L-1 HCl | 20℃ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能通过置换反应得到金属铁的是
A. Na与FeSO4溶液常温混合 B. CO通过灼热的Fe2O3
C. H2通入FeSO4溶液 D. Al和Fe3O4混合加热至高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式不正确的是( )
A. 硫酸型酸雨的形成会涉及反应:2H2SO3+O2===4H++2SO![]()
B. 热的纯碱溶液可以清洗油污的原因:CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-===SiO![]() +H2O
+H2O
D. 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+===Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。

(1)B是____________,W是__________。(填化学式)
(2)用单线桥法标出反应①电子转移的方向和数目:_________________。
(3)写出G与Cu在加热条件下能反应生成E和F的物质的量之比为1∶1的化学方程式:________________________________________________________________________。
(4)若W是酸式盐,_________g W加热分解的产物通过足量的Na2O2,固体Na2O2增重3g,则转移的电子总数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com