
| A. | 原混合溶液中c(K+)为3mol/L | B. | 上述电解过程中共转移4 mol电子 | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 电解后溶液上c(H+)为4 mol/L |
分析 石墨作电极电解此溶液时,阳极发生的反应为:4OH-═2H2O+O2↑+4e-,阴极上发生的电极反应为:Cu2++2e-═Cu,2H++2e-═H2↑,两极均收集到11.2L(标况)气体,即均生成0.5mol的气体,阳极生成0.5mol氧气说明转移了2mol电子,而阴极上生成的0.5molH2只得到了1mol电子,所以剩余1mol电子由铜离子获得,且溶液中有0.5molCu2+,再根据溶液为电中性,遵循电荷守恒可得钾离子物质的量浓度,从该溶液中析出Cu、H2、O2,所以电解后加入一定量的Cu(OH)2可恢复为原溶液.
解答 解:石墨作电极电解此溶液时,阳极发生的反应为:4OH-═2H2O+O2↑+4e-,
阴极上发生的电极反应为:Cu2++2e-═Cu,2H++2e-═H2↑,
两极均收集到11.2L(标况)气体,即均生成0.5mol的气体,阳极生成0.5mol氧气说明转移了2mol电子,而阴极上生成的0.5molH2只得到了1mol电子,所以剩余1mol电子由铜离子获得,且溶液中有0.5molCu2+,
A.c(Cu2+)=$\frac{0.5mol}{0.5L}$=1mol/L,由电荷守恒可得c(K+)=6mol•L-1-1mol/L×2=4mol/L,故A错误;
B.由以上分析可知,述电解过程中共转移2mole-,故B错误;
C.由以上分析可知,溶液中有0.5molCu2+,Cu2++2e-═Cu,所以电解得到的Cu的物质的量为0.5mol,故C正确;
D.电解后,c(K+)=4mol/L,c(NO3-)=6mol•L-1,则由电荷守恒可得c(H+)=6mol•L-1-4mol/L=2mol/L,故D错误;
故选C.
点评 本题考查电解池的工作原理以及溶液中的电荷守恒思想,明确离子的放电顺序及发生的电极反应是解答本题的关键,题目难度中等.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
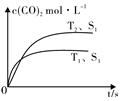 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:| 0.01mol•L-1 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
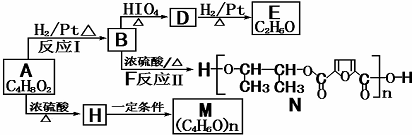
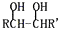 $→_{△}^{HIO_{4}}$RCHO+OHCR′
$→_{△}^{HIO_{4}}$RCHO+OHCR′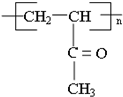
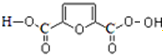 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醚从黄花蒿中提取青蒿素 | |
| B. | 用氯化铁溶液腐蚀铜制印刷电路板 | |
| C. | 在空气净化器中装入活性炭层 | |
| D. | 服用阿司匹林出现水杨酸反应时用小苏打解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
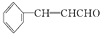 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的: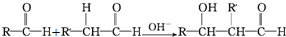
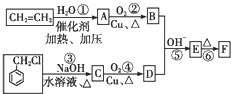
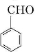 ;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.
;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.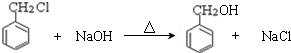 .
.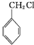 )分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).
)分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).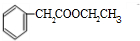
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4•H2O.
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4•H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(稀)→Cu(NO3)2 | |
| B. | Cu+HNO3(浓)→Cu(NO3)2 | |
| C. | Cu$→_{加热}^{浓硫酸}$CuSO4$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$→_{加热}^{空气}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com