
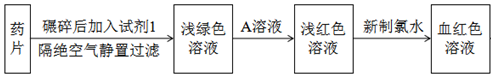
分析 该药品的有效成分是琥珀酸亚铁(暗黄色,难溶于水,易溶于HCl),药片碾碎后加入试剂1为盐酸后溶液为浅绿色,加入A溶液变化为浅红色溶液,加入新制氯水得到血红色溶液,说明A为KSCN溶液,不等加入新制氯水就产生浅红色说明空气中氧气氧化亚铁离子为铁离子,
(1)A溶液中溶质为KSCN,加入A溶液后变红色是空气中氧气氧化亚铁离子生成少量铁离子,加入新制氯水之后变为血红色是氯气氧化亚铁离子为铁离子,结合SCN-离子生成血红色溶液;
(2)甲同学猜想是Fe3+被还原成Fe2+导致褪色,证明甲同学的猜想不合理的实验操作是取少量褪色溶液,再滴入氯水若出现血红色证明合理,若不变红色则不合理;
(3)③将所得固体灼烧至恒重,得到0.8g纯净的红棕色粉末为氧化铁,结合铁元素守恒计算;
解答 解|:该药品的有效成分是琥珀酸亚铁(暗黄色,难溶于水,易溶于HCl),药片碾碎后加入试剂1为盐酸后溶液为浅绿色,加入A溶液变化为浅红色溶液,加入新制氯水得到血红色溶液,说明A为KSCN溶液,不等加入新制氯水就产生浅红色说明空气中氧气氧化亚铁离子为铁离子,
(1)分析可知A溶液中溶质为KSCN,加入A溶液后不等加入新制氯水就产生浅红色的原因是:有少量Fe2+被空气中的氧气氧化为Fe3+,加入新制氯水之后变为血红色是氯气氧化亚铁离子为铁离子,结合SCN-离子生成血红色溶液,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:KSCN; 有少量Fe2+被空气中的氧气氧化为Fe3+;2Fe2++Cl2=2Fe3++2Cl-;
(2)甲同学猜想是Fe3+被还原成Fe2+导致褪色,再滴入氯水若出现血红色证明合理,若不变红色则不合理,证明甲同学的猜想不合理的实验操作是取少量褪色溶液,滴加新制氯水,溶液颜色没有变化,证明甲同学的猜想不合理,
故答案为:新制氯水;溶液颜色没有变化;
(3)③将所得固体灼烧至恒重,得到0.8g纯净的红棕色粉末为氧化铁,结合铁元素守恒计算,
铁元素物质的量=$\frac{0.8g}{160g/mol}$×2=0.01mol,
该药品中铁的质量分数=$\frac{0.01mol×56g/mol}{2.0g}$×100%=28%,
故答案为:28%
点评 本题考查物质的含量的探究实验,为高频考点,把握发生的化学反应及实验操作为解答的关键,侧重分析能力及计算能力的考查,注意信息与所学知识的结合,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C16H18O9 | |
| B. | 0.1mol绿原酸最多与0.8 molNaOH反应 | |
| C. | 能发生取代反应和消去反应 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备氯气时严格检查装置的气密性,并设置尾气吸收装置 | |
| B. | 稀释浓硫酸时,将水倒入浓硫酸中,使用玻璃棒不断搅拌 | |
| C. | 在敞口容器中进行铜与浓硝酸的反应,并观察生成的气体 | |
| D. | 向一支试管中加入少量水,向其中投入一块黄豆大小的钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅可用作光导纤维 | |
| B. | 普通玻璃、陶瓷、水泥属于传统无机非金属材料 | |
| C. | 石英晶体是一种空间立体网状结构的晶体,熔点高,硬度大 | |
| D. | 水玻璃可用于制备硅胶和木材防火剂的原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com