
| A. | 纯水也是一种电解质 | |
| B. | 无论是酸性、中性还是碱性稀溶液,只要温度恒定,c(H+)×c(OH-)是一个常数 | |
| C. | 一定温度下,0.1mol•L-1的磷酸溶液中H+主要来自于酸的第一步电离 | |
| D. | 强碱溶液中不存在H+ |
分析 A.水能够电离出氢离子和氢氧根离子,属于电解质;
B.水的离子积只受温度的影响;
C.多元弱酸的电离一般都主要以第一步为主;
D.无论酸溶液还是碱溶液中都存在氢离子和氢氧根离子.
解答 解:A.水存在电离平衡,能够电离出氢离子和氢氧根离子,所以水是电解质,故A正确;
B.由于水的离子积只受温度的影响,则无论是酸性、中性还是碱性稀溶液,只要温度恒定,c(H+)×c(OH-)是一个常数,故B正确;
C.由于多元弱酸的电离一般都主要以第一步为主,所以在一定温度下,0.1mol•L-1的磷酸溶液中H+主要来自于酸的第一步电离,故C正确;
D.溶液中存在水的电离,所以无论酸性、中性还是碱性溶液中都一定存在氢离子和氢氧根离子,故D错误;
故选D.
点评 本题考查了电解质的电离较强影响,题目难度中等,明确电解质与非电解质、强电解质与弱电解质的概念为解答关键,注意掌握电解质的电离较强影响,试题培养了学生的灵活运用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 21:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁与氢氧化钠溶液混合生成氢氧化亚铁和硫酸钠的反应属于氧化还原反应 | |
| B. | Fe0与一氧化碳反应得到单质铁属于置换反应 | |
| C. | 在自然界中不存在铁单质 | |
| D. | 炽热的铁丝在充满氧气的集气瓶中发生化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
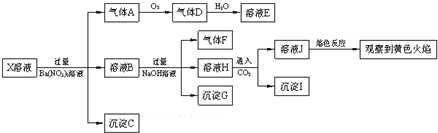
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F在足量氧气中经催化氧化不可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是Fe2+、SO32-、K+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与盐酸; 氢氧化铜与醋酸 | |
| B. | 氯化钡溶液与硫酸铜溶液; 氢氧化钡溶液与硫酸铜溶液 | |
| C. | 碳酸氢钠溶液与稀硫酸 碳酸钠溶液与稀硫酸 | |
| D. | 石灰石与稀硝酸 石灰石与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com