
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32—水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 纯碱溶液呈碱性的原因是CO32—+H2O![]() HCO3—+OH-
HCO3—+OH-
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】某化学小组以环己醇![]() 制备环己烯。已知:
制备环己烯。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
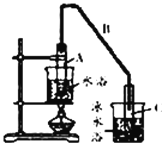
①写出环己醇制备环己烯的化学反应方程式:_________。
②A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_____________。
③试管C置于冰水浴中的目的是_______________________。
(2)环己烯粗品中含有环己醇和少量酸性杂质等,需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在______层(填上或下);分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环己烯热馏,蒸馏时要加入生石灰,目的是__________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分地区水资源缺乏,海水淡化是永恒的话题。下列有关海水淡化的说法错误的是
A.如图制备蒸馏水方法技术成熟,但是成本太高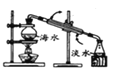
B.如图制备蒸馏水的过程,利用了清洁能源太阳能,且可分离出海水中的盐类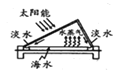
C.如图是离子交换法制备淡水,在阴阳离子交换后发生了酸碱中和反应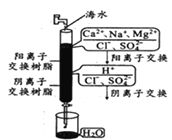
D.如图在阳离子交换过程中阳离子数目保持不变,溶液酸碱性也保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用相应的化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为________;M在元素周期表中的位置为________________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为________________;所含化学键类型__________________________。
(3)X+、Y2-、M2-离子半径大小顺序为__________________。
(4)将YM2通入FeCl3溶液中的离子方程式:_________________________________________。
Ⅱ.如图转化关系(A、B、C中含相同元素)
![]()
![]()
![]()
![]()
![]()
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_________________________。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应生成B的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体的熔点:![]() >
>
B. 晶格能的大小: Al2O3>MgCl2>NaCl
C. 共价键的键长: F-F>C-Cl>C-S>Si-O
D. 硬度由大到小:金刚石>氮化硅>晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:
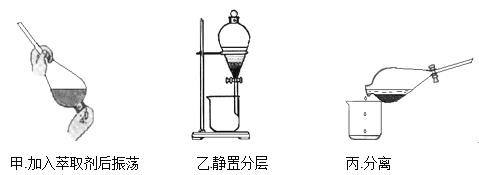
①该同学所采用的萃取剂可能是___(填“A”、“B”或“C”)。
A.酒精 B.苯 C.四氯化碳
②甲、乙、丙3步实验操作中,不正确的是___(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

实验室制取氯气的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法不正确的是
A. 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质
B. 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造晶体管
C. Ni-Zn化合物的纳米颗粒可作![]() 反应的催化剂,提高苯的转化率
反应的催化剂,提高苯的转化率
D. 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确且与对应操作和目的相符的是
选项 | 目的 | 操作 | 离子方程式 |
A | 比较Fe2+和Br还原性强弱 | 向FeBr2溶液中滴入少量氯水 | 2Br+Cl2=Br2+2Cl |
B | 比较C、Si非金属性强弱 | 向硅酸钠溶液中通入少量二氧化碳 | SiO32-+CO2+H2O=H2SiO3↓+CO32- |
C | 除去CO2中的SO2 | 将气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | CO32-+SO2= SO32-+CO2 |
D | 实验室制取氯气 | 向MnO2固体中加入浓盐酸并加热 | MnO2+4HCl(浓) +2Cl +Cl2↑+2H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
(实验一)实验步骤如下:
向新制的Na2S溶液中滴加新制的氯水
设计该实验方案的目的是:探究同周期元素的性质递变规律。
(1)实验①的现象是_____________________,反应的离子方程式是_________________。
(实验二)为验证Cl、Br的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.
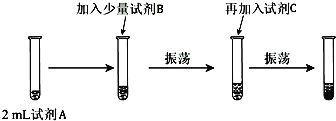
(2)试剂A是NaBr溶液,试剂B是氯水,加C后出现分层,则试剂C是____________.
(3)加入C振荡、静置后看到的现象是:______________________________________。以上反应可以证明Cl的非金属性__________(填“强于”或“弱于”)Br的非金属性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com