
【题目】金属腐蚀的本质是金属与其接触的其他物质在一定条件下发生氧化还原反应而受到损害。下列不属于化学或电化学防腐方法的是( )
A. 在金属表面涂刷一层油漆
B. 利用电镀技术在金属表面镀上一层其他金属
C. 用阳极氧化处理使铝表面形成致密的氧化物膜
D. 利用特殊工艺在钢铁表面生成一层致密的Fe3O4薄膜
科目:高中化学 来源: 题型:
【题目】核电荷数 1~18 的四种元素 W、X、Y、Z,原子序数依次变小,原子核外电子层数之和是 8。W 单质是银白色固体、导电性强,在空气中燃烧发出黄色的火焰;X 元素原子最外层电子层上的电子数 是 Y 和 Z 两元素原子最外层上的电子数的总和;Y 元素原子的最外电子层上的电子数是它的电子层数 的 2 倍,X 和 Z 可以形成 XZ3 的化合物,请回答:
(1)X 元素的原子结构示意图是________________;Y 元素的名称是________________;Z 的阴 离子的电子式:________________。
(2)分别写出 X、Y 的最高价含氧酸的化学式________________、________________。
(3)W 和 X 可形成化合物,它能与水剧烈反应产生 XZ3,所发生的化学方程式为:________________,该化合物中 W 离子的电子式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以用废铁屑制备活性Fe3O4,流程如下图:
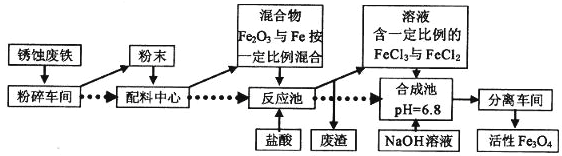
(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________
(2)在合成池里生成Fe3O4的离子方程式为__________________________
(3)假如在反应池中几乎没有气体产生,根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):

操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
①操作Ⅱ中“……”的内容是______________,烧杯中的现象是________________,相应的方程式是________________、________________。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是![]() ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子最外层电子数为次外层电子数的3倍。E与D位于同一主族。A、B、D三种元素组成的一种化合物X是新装修居室中常含有的一种有害气体。由A、C、D、E、F五种元素按照原子个数比为14∶4∶5∶1∶1形成的化合物Y为深蓝色晶体。
回答下列问题:
(1) 基态E原子的价电子排布图为_____________________。
(2) 形成化合物Y的五种元素中第一电离能最大的是__________;电负性最大的是________(填元素符号)。
(3) 化合物X中心原子的杂化方式为________,X分子中的两种键角的大小关系是_________________(用∠XYZ表示,X、Y、Z代表元素符号)。
(4) C2D分子的立体结构为________________;A分别与B、C形成的简单化合物熔、沸点由高到低顺序为________(用化学式表示),简单说明原因_________________。
(5) 晶体Y中存在的化学键类型有_____________________。(填代号)
A、离子键 B、非极性共价键 C、配位键 D、氢键 E、σ键 F、金属键
(6) 下图是D、F两种元素形成的化合物的晶胞结构示意图,F的配位数是_______________;已知晶胞中最近的两个D原子间距离为a nm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是

A. ab点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3H2O的电离平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖分解代谢的叙述,错误的是
A. 甜菜细胞中的蔗糖经水解可产生葡萄糖和果糖
B. 各种糖类都可以氧化分解,为细胞供能
C. 发芽小麦种子中的麦芽糖经水解可产生葡萄糖
D. 纤维素经微生物水解可产生葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硫元素表现出氧化性的是
A. H2SO4+Zn=ZnSO4+H2↑ B. 2SO2+O2![]() 2SO3
2SO3
C. 2H2SO4(浓)+Cu![]() CuSO4(浓)+SO2↑+2H2O D. SO3+H2O=H2SO4
CuSO4(浓)+SO2↑+2H2O D. SO3+H2O=H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学欲在实验室中用乙醇制备1,2-二溴乙烷。
甲同学设计的实验装置如下图:
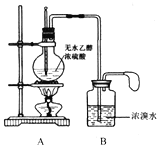
(1)请写出A和B中发生的主要反应的化学方程式
A:________________________________________。
B:________________________________________。
(2)乙同学查阅资料得知:
①此反应可能存在的主要副反应有:在浓硫酸的存在下,乙醇可发生如下反应生成乙醚, ![]()
②乙醚不与溴水反应
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
颜色、状态 | 无色液体 | 无色液体 | 无色液体 |
沸点/℃ | 78.5 | 132 | 34.6 |
若最终产物中混有少量乙醚,可用__________的方法除去。
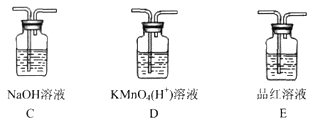
(3)丙同学观察到:在实验后期A中液体变黑,认为应该在装置A和B之间加入装置__________(填序号),此装置的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,标准状况下均产生5.6 L气体,则两份铝片的质量之比为
A. 一定为1∶1 B. 可能为2∶3 C. 一定为3∶2 D. 可能为1∶6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com