
【题目】核电荷数 1~18 的四种元素 W、X、Y、Z,原子序数依次变小,原子核外电子层数之和是 8。W 单质是银白色固体、导电性强,在空气中燃烧发出黄色的火焰;X 元素原子最外层电子层上的电子数 是 Y 和 Z 两元素原子最外层上的电子数的总和;Y 元素原子的最外电子层上的电子数是它的电子层数 的 2 倍,X 和 Z 可以形成 XZ3 的化合物,请回答:
(1)X 元素的原子结构示意图是________________;Y 元素的名称是________________;Z 的阴 离子的电子式:________________。
(2)分别写出 X、Y 的最高价含氧酸的化学式________________、________________。
(3)W 和 X 可形成化合物,它能与水剧烈反应产生 XZ3,所发生的化学方程式为:________________,该化合物中 W 离子的电子式为________________。
【答案】  碳 [H :] HNO3 H2CO3 Na3N+3H2O→NH3↑+3NaOH Na+
碳 [H :] HNO3 H2CO3 Na3N+3H2O→NH3↑+3NaOH Na+
【解析】W 单质是银白色固体、导电性强,在空气中燃烧发出黄色的火焰,可知W为Na元素;四元素原子核外电子层数之和是8,则Z处于第一周期,X和Y处于第二周期,可推知Z为H元素;Y 元素原子的最外电子层上的电子数是它的电子层数 的 2 倍,则Y为碳元素,X 元素原子最外层电子层上的电子数 是 Y 和 Z 两元素原子最外层上的电子数的总和,则X元素的最外层电子数为5,为氮元素;
(1)X 为氮元素,核电荷数为7,其原子结构示意图是 ;Y 元素的名称是碳;氢的阴 离子的电子式为[H :];
;Y 元素的名称是碳;氢的阴 离子的电子式为[H :];
(2)N的最高价为+5价、C的最高价为+4价,它们对应的最高价含氧酸的化学式为HNO3、H2CO3;
(3)Na和N 可形成离子化合物Na3N,它能与水剧烈反应产生 NH3,所发生的化学方程式为Na3N+3H2O=NH3↑+3NaOH,离子化合物Na3N中 钠离子的电子式为Na+。


科目:高中化学 来源: 题型:
【题目】[2016新课标Ⅰ]NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为___________,该反应中氧化产物是____________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘元素是一种有多种化合价的非金属元素。
(1)足量的碘与56 g铁充分反应,转移的电子数为 NA;反应KIO4+8HI![]() 4I2+KI+4H2O中氧化剂与还原剂的物质的量之比为 。
4I2+KI+4H2O中氧化剂与还原剂的物质的量之比为 。
(2)在一支试管中按某顺序加入下列几种物质(一种物质只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液D.稀H2SO4 E.H2O2溶液
发现溶液颜色有如下变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。则加入药品的顺序是(写序号) ,③→④反应的化学方程式为 。
(3)工业上制得的粗碘中通常含卤素互化物ICl、IBr,受热时ICl和IBr均可像I2一样升华,在粗碘中加入以下选项中的一种物质后,再进行升华可制得精碘,应加入的物质是 。
a.KBr b.KCl c.KI d.Zn
(4)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是 。
(5)医药工业的重要原料高碘酸钠可采用氯气氧化法制备。工艺流程如图:
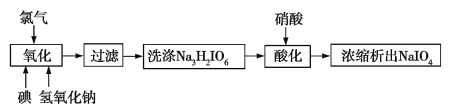
写出氧化过程中发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法正确的)

A. 该试剂的物质的量浓度为 9.2 mol·L —1
B. 该硫酸 50 mL 与足量的铜反应可得到标准状况下 SO2 10.3 L
C. 配制 200 mL 4.6 mol·L —1 的稀硫酸需取该硫酸 50 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于 49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017天津卷]H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3 ![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O
2Fe2(SO4)3 +2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
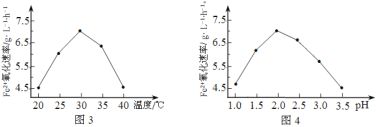
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双减法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+ H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_________________ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Mg2+、Ag+、Ba2+ 3种阳离子,欲将3种离子逐一沉淀出来,下列加入试剂的顺序中,正确的是
①NaOH溶液、NaCl溶液、Na2SO4溶液
②NaOH溶液、Na2SO4溶液、NaCl溶液
③NaCl溶液、Na2SO4溶液、NaOH溶液
④NaCl溶液、NaOH溶液、Na2SO4溶液
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功研制出一种全新的铝—石墨双离子电池(AGDIB)。这种新型AGDIB电池采用廉价且易得的石墨作为电池正极材料,铝锂(AlLi)合金作为负极材料,LiPF6是电解质,碳酸酯为溶剂,反应原理是 AlLi + Cx(PF6)![]() LiPF6 + xC + Al。
LiPF6 + xC + Al。
下列关于该电池的说法不正确的是
A. 该电池不能用水溶液作为电解质
B. 放电时,Li+在电解质中由负极向正极迁移
C. 充电时,若转移1 mol e—,阴极电极将增重7g
D. 放电时,正极的电极反应式为AlLi-e-=Li+ + Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属腐蚀的本质是金属与其接触的其他物质在一定条件下发生氧化还原反应而受到损害。下列不属于化学或电化学防腐方法的是( )
A. 在金属表面涂刷一层油漆
B. 利用电镀技术在金属表面镀上一层其他金属
C. 用阳极氧化处理使铝表面形成致密的氧化物膜
D. 利用特殊工艺在钢铁表面生成一层致密的Fe3O4薄膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com