
����Ŀ��[2017����]H2S��SO2��Ի��������彡�����������Σ������ҵ�ϲ�ȡ���ַ���������Щ�к�������ŷţ��ش����з����е����⡣
����H2S�ij�ȥ
����1��������H2S��ԭ��Ϊ��
H2S+Fe2(SO4)3 ![]() S��+2FeSO4+H2SO4
S��+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O
2Fe2(SO4)3 +2H2O
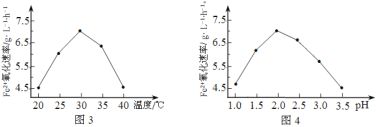
��1����˾�����ʱ��FeSO4����������������ʱ��5��105�����þ���������______________��
��2����ͼ3��ͼ4�ж�ʹ����˾����������Ϊ______________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����______________��
����2����һ�������£���H2O2����H2S
��3�����Ųμӷ�Ӧ��n(H2O2)/n(H2S)�仯���������ﲻͬ����n(H2O2)/n(H2S)=4ʱ����������ķ���ʽΪ__________��
����SO2�ij�ȥ
����1��˫����������NaOH����SO2������CaOʹNaOH����
NaOH��Һ![]() Na2SO3��Һ
Na2SO3��Һ
��4��д�������������ӷ���ʽ��____________________________��CaO��ˮ�д�������ת����
CaO(s)+ H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
��ƽ���ƶ��ĽǶȣ�����������NaOH������ԭ��____________________________________��
����2���ð�ˮ��ȥSO2
��5����֪25����NH3��H2O��Kb=1.8��105��H2SO3��Ka1=1.3��102��Ka2=6.2��108������ˮ��Ũ��Ϊ2.0 mol��L1����Һ�е�c(OH)=_________________ mol��L1����SO2ͨ��ð�ˮ�У���c(OH)����1.0��107 mol��L1ʱ����Һ�е�c(![]() )/c(
)/c(![]() )=___________________��
)=___________________��
���𰸡���1�����ͷ�Ӧ��ܣ�����������
��2��30 ����pH=2.0 �����ʱ��ԣ�����˾�ʧȥ���ԣ�
��3��H2SO4
��4��2OH+SO2![]()
![]() +H2O
+H2O
![]() ��Ca2+����CaSO3������ƽ���������ƶ�����NaOH����
��Ca2+����CaSO3������ƽ���������ƶ�����NaOH����
��5��6.0��103 0.62
����������1��������˾�����ʱ�ķ�Ӧ��������ʱ��5��105����֪����Ӧ����������������˾����������������������˷�Ӧ�Ļ�ܡ�
��2������ͼ3��֪���¶�30������ʱ���������������ͼ4��֪��pH=2.0ʱ���������������ʹ����˾����������Ϊ30����pH=2.0������Ӧ�¶ȹ��ߣ���˾������ʱ���ʧȥ������ɷ�Ӧ�����½���
��3�����ݻ��ϼ���������n(H2O2)/n(H2S)=4ʱ��4 mol H2O2ת��8 mol���ӣ���1 mol H2SҲת��8 mol���ӣ����ϼ۴�2�����ߵ�+6�ۣ�������������ΪH2SO4��
��4����������NaOH��SO2�ķ�Ӧ����Ӧ�����ӷ���ʽΪ2OH+SO2![]()
![]() +H2O������CaO��ˮ�е�ת����CaO(s)+H2O(l)
+H2O������CaO��ˮ�е�ת����CaO(s)+H2O(l)![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)����������Na2SO3����CaO��
Ca2+(aq)+2OH(aq)����������Na2SO3����CaO��![]() ��Ca2+����CaSO3������ƽ���������ƶ�����NaOH���ɡ�
��Ca2+����CaSO3������ƽ���������ƶ�����NaOH���ɡ�
��5������NH3��H2O��Kb=1.8��105��֪��![]() =1.8��105������ˮ��Ũ��Ϊ2.0 mol��L1ʱ����Һ�е�c(OH)= c(
=1.8��105������ˮ��Ũ��Ϊ2.0 mol��L1ʱ����Һ�е�c(OH)= c(![]() )=
)=![]() =6.0��103 mol��L1��
=6.0��103 mol��L1��
����H2SO3��Ka2=6.2��108��֪��![]() =6.2��108����c(OH)����1.0��107 mol��L1����c(H+)=1.0��107 mol��L1����Һ�е�c(
=6.2��108����c(OH)����1.0��107 mol��L1����c(H+)=1.0��107 mol��L1����Һ�е�c(![]() )/c(
)/c(![]() )=0.62��
)=0.62��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �ơ�����������������ȼ�����ɰ�ɫ����
B. ͭ˿��������ȼ�գ���������ɫ���Ȼ�ͭ
C. ����Cl2�������Ƿ����HCl�ķ����ǽ�����ͨ����������Һ
D. ��CO2ͨ����������Һ�����ɾ���Ư���Ե�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A����ӦN2 (g) +3H2 (g) ![]() 2NH3 (g)����H < 0����S >0
2NH3 (g)����H < 0����S >0
B�����¸����ܵ��õ�������п����Լ����ܵ��ĸ�ʴ
C�������£�Ksp[Mg(OH)2]=5.6��10-12��pH=10�ĺ�Mg2+��Һ�У�c(Mg2+ )��5.6��10-4 mol��L-1
D�����³�ѹ�£�п��ϡH2SO4��Ӧ����11.2 L H2����Ӧ��ת�Ƶĵ�����Ϊ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����c��CH3COOH��+c��CH3COO-��=0.1molL-1��һ����ᡢ�����ƻ����Һ����Һ��c��CH3COOH����c��CH3COO-����pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ��������ȷ���ǣ�������

A. pH=5.5����Һ�У�c��CH3COOH����c��CH3COO-����c��H+����c��OH-��
B. ���¶��´���ĵ���ƽ�ⳣ��Ϊ10-4.75
C. pH=3.5����Һ�У�c��Na+��+c��H+��+c��OH-��+c��CH3COOH��=0.1molL-1
D. ��W������ʾ����Һ�м���������0.05molL��1NaOH��Һ��c��H+��=c��CH3COOH��+c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˵���� 1~18 ������Ԫ�� W��X��Y��Z��ԭ���������α�С��ԭ�Ӻ�����Ӳ���֮���� 8��W ����������ɫ���塢������ǿ���ڿ�����ȼ�շ�����ɫ�Ļ��棻X Ԫ��ԭ���������Ӳ��ϵĵ����� �� Y �� Z ��Ԫ��ԭ��������ϵĵ��������ܺͣ�Y Ԫ��ԭ�ӵ�������Ӳ��ϵĵ����������ĵ��Ӳ��� �� 2 ����X �� Z �����γ� XZ3 �Ļ������ش�
��1��X Ԫ�ص�ԭ�ӽṹʾ��ͼ��________________��Y Ԫ�ص�������________________��Z ���� ���ӵĵ���ʽ��________________��
��2���ֱ�д�� X��Y ����ۺ�����Ļ�ѧʽ________________��________________��
��3��W �� X ���γɻ����������ˮ���ҷ�Ӧ���� XZ3���������Ļ�ѧ����ʽΪ��________________���û������� W ���ӵĵ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(14��)��(As)��һЩ�����Ϳ�ɽ��ˮ�е���ȾԪ��,ʹ����������ȥ��ˮ�������Ч�� ʩ֮һ��
(1)�������̡�������������������Һ��һ���������,����ʹ���ַ�Ӧ,�ɻ��һ����ĸ�Ч������X,������X�к���![]() ,��ԭ����___________________________________��
,��ԭ����___________________________________��
��2��H3AsO3��H3AsO4ˮ��Һ�к���ĸ����ֵķֲ�����(ƽ��ʱij���ֵ�Ũ��ռ������ Ũ��֮�͵ķ���)��pH�Ĺ�ϵ�ֱ�����20ͼ- 1����20ͼ- 2��ʾ��
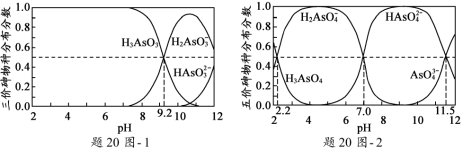
���Է�̪Ϊָʾ��(��ɫ��ΧpH 8.0 ~ 10.0),��NaOH��Һ��μ��뵽H3AsO3��Һ��,����Һ����ɫ��Ϊdz��ɫʱֹͣ�μӡ��ù�������Ҫ��Ӧ�����ӷ���ʽΪ_____________________��
��H3AsO4��һ�����뷽��ʽH3AsO4![]() H2AsO4-+H+�ĵ��볣��ΪKa1,��pKa1=_________(p Ka1 = -lg Ka1 )��
H2AsO4-+H+�ĵ��볣��ΪKa1,��pKa1=_________(p Ka1 = -lg Ka1 )��
��3����Һ��pH��������X�������������Ӱ�졣pH =7. 1ʱ, ������X���治�����; pH > 7.1ʱ�������,pHԽ��,�������������Խ��;pH<7.1ʱ�������,pHԽ��,�������������Խ�ࡣpH��ͬʱ������X���������������ƽ��������(������ƽ��ʱ��λ����������X�����������)����20ͼ-3��ʾ��ѧ��&��
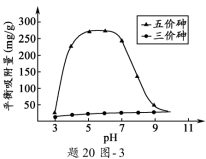
����pH7~9֮��,������X��������ƽ����������pH���߶�Ѹ���½�,��ԭ����____________________��
����pH4~7֮��,������X��ˮ���������ȥ������Զ����������,������Ϊ___________�� ���������X��������ȥ��Ч���ɲ�ȡ�Ĵ�ʩ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ҹ������ƾõ���ʷ������������ϲ����������˳ƺȲ�Ϊ������������Ҷ�к��зḻ�Ŀ�����(C8H10N4O2����Է�������Ϊ194)�����˷�����������ƣ�͡����һ���躬��0.194 g���������������ʵ���Ϊ(����)
A. 4.00��10��3mol B. 3.00��10��3mol
C. 2.00��10��3mol D. 1.00��10��3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г���I��II��ȷ�����������ϵ���� (����)
ѡ�� | ����I | ����II |
A | �����Էֱ��NaOH��Һ�����ᷴӦ | �����н��������зǽ����� |
B | Na2CO3������θҩ | Na2CO3���Ժ����ᷴӦ |
C | Ӳ���ǺϽ� | ���۵�Ƚ��������۵�� |
D | Na2O2����ǿ������ | Na2O2������ΪƯ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ƿֽ��л���������������
A. ���ϸ���е����Ǿ�ˮ��ɲ��������Ǻ���
B. ����������������ֽ⣬Ϊϸ������
C. ��ѿС�������е���ѿ�Ǿ�ˮ��ɲ���������
D. ��ά�ؾ�����ˮ��ɲ���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com