
【题目】下列说法正确的是
A.反应N2 (g) +3H2 (g) ![]() 2NH3 (g)的ΔH < 0,ΔS >0
2NH3 (g)的ΔH < 0,ΔS >0
B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C.常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1
D.常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A.蒸馏B.萃取C.干馏D.升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁是般常用的金属之一,其铁合金及其化合物有着重要的用途。
(l)某种铁碳化合物X是炼钢的原料,经分析可知,X中铁、碳两元素的质量比为14:1,则X的化学式________;X在足量的空气中高温煅烧,生成有磁性的固体Y和能使澄消石灰水变浑浊的气体,该反应的化学方程式为___________________。
(2)铁钛合金是一种常用不锈钢材料,某同学在探究该合金性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2Fe3++Fe=3Fe2+ ②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③_______________________。
(3)氧化铁是重要的工业原料,用废铁屑制备它的流程如下:
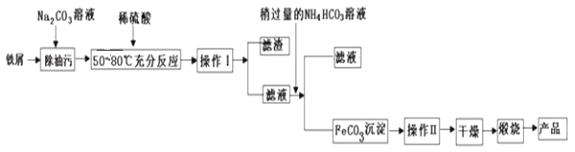
回答下列问题:
①操作Ⅱ的名称是_________。
②请完成生成FeCO3沉淀的离子方程式:_____________;FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol/L。试判断所得FeCO3固体是否混有Fe(OH)2:____(填“是”或“否”),请通过简单计算说明理由___________。
(已知Ksp[Fe(OH)2]=4.9×10-17mol3·L-3 、Ksp[FeCO3]=2.1×10-11mol2·L-2)
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+。
_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
![]()
A. 若D是一种强碱,则A、B、C均可与X反应生成D
B. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
C. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用金属活动性顺序表解释的是
A. 使用铝制水壶烧水
B. 用铁丝而不用铜丝做焰色反应的实验
C. 工业上常用热还原法冶炼铁,用电解法冶炼钠
D. 铝既能与强酸溶液反应,也能与强碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘元素是一种有多种化合价的非金属元素。
(1)足量的碘与56 g铁充分反应,转移的电子数为 NA;反应KIO4+8HI![]() 4I2+KI+4H2O中氧化剂与还原剂的物质的量之比为 。
4I2+KI+4H2O中氧化剂与还原剂的物质的量之比为 。
(2)在一支试管中按某顺序加入下列几种物质(一种物质只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液D.稀H2SO4 E.H2O2溶液
发现溶液颜色有如下变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。则加入药品的顺序是(写序号) ,③→④反应的化学方程式为 。
(3)工业上制得的粗碘中通常含卤素互化物ICl、IBr,受热时ICl和IBr均可像I2一样升华,在粗碘中加入以下选项中的一种物质后,再进行升华可制得精碘,应加入的物质是 。
a.KBr b.KCl c.KI d.Zn
(4)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是 。
(5)医药工业的重要原料高碘酸钠可采用氯气氧化法制备。工艺流程如图:
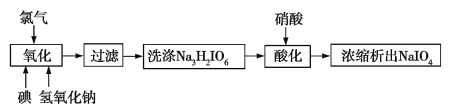
写出氧化过程中发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017天津卷]H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3 ![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O
2Fe2(SO4)3 +2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
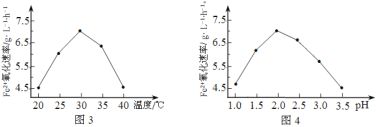
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双减法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+ H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_________________ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com