
可逆反应A+B(s)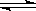 C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
A. A为固体,C为气体,正反应为放热反应
B. A为气体,C为固体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应
D. A、C均为气体,正反应为吸热反应
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:单选题
下列关于各图的叙述中,正确的是
A.图甲表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量
B.图甲表示2 mol H2(g)所具有的能量比2 molH2O(g)所具有的能量多483.6 kJ
C.图乙表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH
D.图乙中起始时HA的物质的量浓度大于HB
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法或表示方法正确的是 ( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
C.300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| D.由C(石墨)=C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知298 K,101 kPa时,2SO2(g)+O2(g)  2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
降低大气中CO2的含量、减缓温室效十分重要。
(1)工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
上图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示。则加入催化剂的曲线是 (填:a或b);
0—8min内该反应的平均速率v(CO2)= mol/(L·min)。
(3)在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为a kJ,破坏1molO=O键消耗的能量为bkJ,形成1molC=O键释放的能量为ckJ。则1molCO在空气中完全燃烧生成CO2放出的能量为
kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究。已知:
①P4(s、白磷)+5O2(g)=P4O10(s);Δ H=-2983.2 KJ·mol-1
②P(s、红磷)+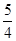 O2(g)=
O2(g)= P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1
试写出白磷转化为红磷的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1) 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图, 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。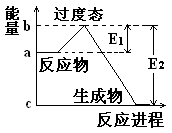
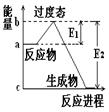
(2)在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com