
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸与铜反应制取硫酸铜。该反应的化学方程式是 ,此法的最大缺点是 。
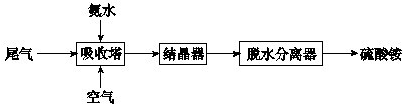
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
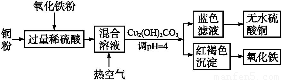
稀硫酸、铜和氧化铁反应的化学方程式是 ;向混合溶液中通入热空气的反应的离子方程式是 ;由滤液得到无水硫酸铜的实验操作是 。
(2)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。
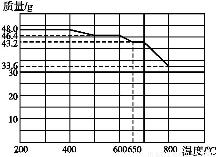
根据图像推断670 ℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论) ???????????????????????????????????????????????????????????????? 。
仪器自选。可供选择的试剂:稀硫酸、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
(1)①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 产生有污染的气体
CuSO4+SO2↑+2H2O 产生有污染的气体
②Fe2O3+6H+ 2Fe3++3H2O、2Fe3++Cu
2Fe3++3H2O、2Fe3++Cu 2Fe2++Cu2+(或Fe2O3+Cu+6H+
2Fe2++Cu2+(或Fe2O3+Cu+6H+ 3H2O+2Fe2++Cu2+)
3H2O+2Fe2++Cu2+)
4Fe2++4H++O2 4F
4F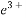 +2H2O 加热、蒸发
+2H2O 加热、蒸发
(2)FeO 取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变为红色,证明还原产物为FeO(要点:三组操作与现象、最终结论)
【解析】(2)n(Fe2O3)=0.3 mol,反应过程中减少的质量只能是氧元素的质量m(O)=(48-43.2) g=4.8 g,减少n(O)=0.3 mol,670 ℃时Fe2O3还原产物中n(Fe)=2n(Fe2O3)=0.6 mol、n(O)=3n(Fe2O3)-0.3 mol=0.6 mol,化学式为FeO;要证明还原产物中无铁单质及三价铁


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2014届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
硫酸是用途广泛的化工原料,可作脱水荆、吸水荆、氧化剂和催化荆等。
工业制硫酸铜的方法很多。
(1)方法一、用浓硫酸制取硫酸铜。该反应的化学方程式是____ ,
此法的最大缺点是__ __。
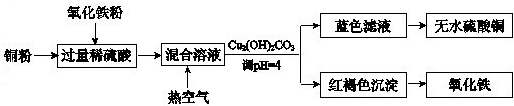
(2) 方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
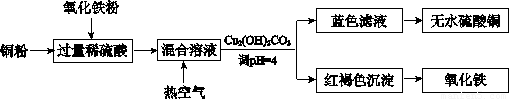
稀硫酸、铜和氧化铁反应的离子方程式是 、 ;向混合溶液中通人热空气的反应的离子方程式是 ;由滤液得到无水硫酸铜的实验操作是 。
查看答案和解析>>
科目:高中化学 来源:2014届河南省洛阳市高三上学期期中考试化学试卷B(解析版) 题型:填空题
硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化荆和催化剂等。
工业制硫酸铜的方法很多。
(1)方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_____________________,此法的最大缺点是____________________________。
(2)方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
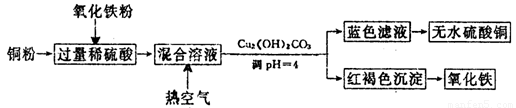
①稀硫酸、铜和氧化铁反应的离子方程式是__________________、________________;
向混合溶液中通入热空气的反应的离子方程式是_______________________________。
②请说出调整PH为4的目的是_______________________;由滤液得到无水硫酸铜的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源:2013年北京市西城区高考化学一模试卷(解析版) 题型:填空题
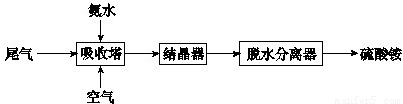
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com