
| A. | Na2S 溶液中 c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-) | |
| C. | 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合:溶液中离子浓度的大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.1mol•L-1的NaHC2O4溶液的pH=4,则c(H C2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) |
分析 A.根据溶液中的质子守恒分析;
B.根据物料守恒分析;
C.pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,醋酸过量,溶液中溶质为醋酸和醋酸钠;
D.0.1mol•L-1的NaHC2O4溶液的pH=4,NaHC2O4的电离程度大于水解程度.
解答 解:A.Na2S 溶液中水电离的氢离子的量与水的电离的氢氧根离子相等,则溶液中质子守恒为:c(OH-)=c(H+)+c(HS-)+2c(H2S),故A正确;
B.Na2CO3溶液中钠离子的总浓度等于2倍的含碳微粒的总浓度,即:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C.pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,醋酸过量,溶液中溶质为醋酸和醋酸钠,溶液显酸性,则溶液中离子浓度的大小顺序为:(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.0.1mol•L-1的NaHC2O4溶液的pH=4,NaHC2O4的电离程度大于水解程度,则c(H C2O4-)>c(H+)>c(C2O42-)>c(H2C2O4),故D错误.
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,知道荷守恒和物料守恒的正确运用,强酸弱碱盐或强碱弱酸盐能发生水解但程度较小,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(无水硫酸铜) | ||
| C. | 硝基苯中的混酸(NaOH溶液) | D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶作袋装食品的干燥剂 | |
| B. | 氯气作自来水杀菌消毒剂 | |
| C. | 用铂丝蘸取碳酸钠溶液在酒精灯外焰上灼烧 | |
| D. | 用蒸馏的方法除去自来水中的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
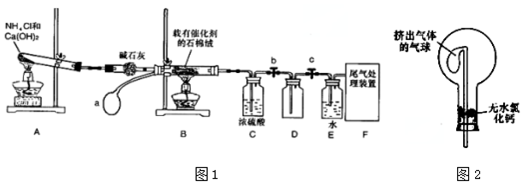
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
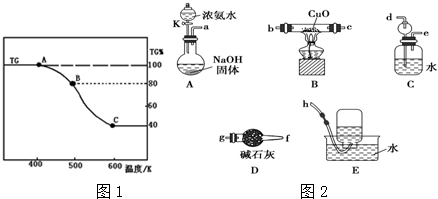
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 汽油、酒精、NaCl溶液 | B. | 汽油、四氯化碳、水 | ||
| C. | 汽油、酒精、NaOH溶液 | D. | 汽油、苯、NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com