
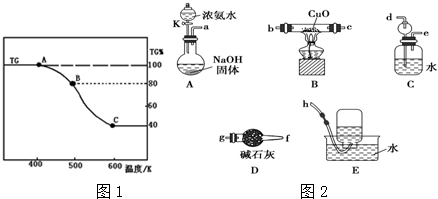
分析 (1)根据证明Al(OH)3呈两性的试剂选择;
(2)根据转化关系判断物质的稳定性;
(3)①由于反应中由氨气生成,烧瓶内压强大,导致氨水不能滴下,据此分析可能原因;
②根据题干信息判断反应物、生成物,然后写出反应的化学方程式;
③氨气极易溶于水,容易发生倒吸现象,使用球形漏斗可以防止倒吸现象.
解答 解:(1)证明Al(OH)3呈两性的试剂是强酸和强碱,要想证明Cu(OH)2呈两性,也必须选强酸和强碱溶液.硫酸是强酸,氢氧化钠是强碱,所以可以选取;
故答案为:bc;
(2)①物质由不稳定物质转化为稳定物质的倾向,所以在高温条件下,十l价的Cu比十2价Cu更稳定;
故答案为:稳定;
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,这说明氧化亚铜和稀硫酸反应生成的是硫酸铜、水和单质铜,因此该反应的离子化学方程式为:Cu2O+2H+=Cu2++Cu+H2O,这说明在酸性溶液中,+1价Cu比+2价Cu更不稳定;
故答案为:Cu2O+2H+=Cu2++Cu+H2O;不稳定;
(3)A装置是制备氨气的,生成的氨气中含有水蒸气,需要通过碱石灰干燥.又因为氨气极易溶于水,过量的氨气在进行尾气处理时需要防止倒吸,所以正确的连接顺序为:a→g→f→b→c→d→e→h,
故答案为:g;f;b;c;d;e;
①由于反应中由氨气生成,烧瓶内压强大,导致氨水不能滴下,即:可能的原因是没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔),
故答案为:没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔);
②实验结束后,装置B中固体由黑色变为红色,这说明有导致铜生成,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,因此钙气体应该是氮气,所以B装置中发生的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
故答案为:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O;
③由于氨气极易溶于水,直接通入水中吸收,容易倒吸,所以装置C中的球形装置的作用是防倒吸,故答案为:防倒吸.
点评 本题考查了Cu的常见化合物的性质的实验探究,采用假设的方法判断铜的常见化合物的性质,然后作实验验证;要注意的是:有有毒气体产生时,一定有尾气处理装置,不能直接排空.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2S 溶液中 c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-) | |
| C. | 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合:溶液中离子浓度的大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.1mol•L-1的NaHC2O4溶液的pH=4,则c(H C2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Fe→Fe(OH)3→Fe2O3→Fe(NO3)3 | ||
| C. | HCl→Cl2→HClO→NaClO | D. | Al→Al2O3→Al(OH)3→AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和液氯是两种不同的物质 | |
| B. | 可以用浓硫酸除去氯气中的水蒸气 | |
| C. | 氯气是一种有毒气体,但可用于自来水的杀菌消毒 | |
| D. | 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400 mL | B. | 600 mL | C. | 500 mL | D. | 480 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
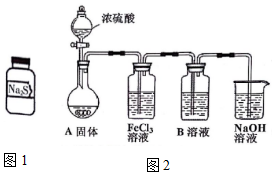 有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,
有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com