
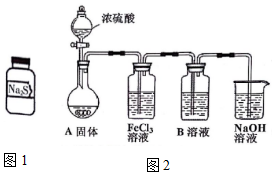
 有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,
有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,分析 (1)配制溶液时需要玻璃棒进行搅拌,加速溶解;
(2)根据各物质与盐酸的反应分析有气体产生的可能;Na2SO3溶液加入硝酸酸化的BaCl2溶液产生的白色沉淀为硫酸钡;
(3)硝酸能氧化亚硫酸根离子,考虑不使用硝酸钡;
(4)向B溶液中滴加H2SO4溶液,观察到沉淀和气体,则B溶液为Na2S2O3,Na2S2O3水解显碱性;
(5)①根据装置:烧瓶中浓硫酸与亚硫酸钠反应生成二氧化硫气体,二氧化硫气体与氯化铁发生氧化还原反应,到B溶液Na2S2O3溶液中,二氧化硫溶于水显酸性使Na2S2O3溶液发生歧化反应生成硫单质,溶液浑浊,最后氢氧化钠吸收未反应完的二氧化硫;
②FeCl3溶液中发生了氧化还原反应2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+,根据产物亚铁离子和硫酸根离子的性质可设计验证.
解答 解:(1)配制溶液时玻璃棒的作用是进行搅拌,加速固体的溶解;
故答案为:搅拌或加速固体溶解;
(2)取A溶液加入盐酸,有气体产生的为Na2S+2HCl=2NaCl+H2S↑,Na2SO3+2HCl=2NaCl+H2O+SO2↑,Na2S2O3+2HCl=2NaCl+H2O+SO2↑+S↓;Na2SO3溶液加入硝酸酸化的BaCl2溶液观察到白色沉淀,则该白色沉淀为硫酸钡;
故答案为:Na2S、Na2SO3、Na2S2O3;BaSO4;
(3)硝酸具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子生成硫酸钡沉淀,不能排除硫酸钠,所以应选用盐酸酸化的氯化钡溶液,所以应取A溶液滴加BaCl2溶液观察到白色沉淀,再滴加稀盐酸,沉淀完全溶解,即可证明A溶液为Na2SO3;
故答案为:滴加BaCl2溶液观察到白色沉淀,再滴加稀盐酸,沉淀完全溶解;
(4)向B溶液中滴加H2SO4溶液,观察到沉淀和气体,则B溶液为Na2S2O3,发生的反应为Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓;Na2S2O3水解反应:S2O32-+H2O?HS2O3-+OH-,所以溶液显碱性;
故答案为:S2O32-+H2O?HS2O3-+OH-;
(5)①根据装置:烧瓶中浓硫酸与亚硫酸钠反应生成二氧化硫气体,二氧化硫气体与氯化铁发生氧化还原反应:2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+,到B溶液Na2S2O3溶液中,二氧化硫溶于水显酸性使Na2S2O3溶液发生歧化反应:H2O+SO2+S2O32-=S↓+2HSO3-,生成硫单质,溶液浑浊,最后氢氧化钠吸收未反应完的二氧化硫;
故答案为:H2O+SO2+S2O32-=S↓+2HSO3-;酸性;
②FeCl3溶液中发生了氧化还原反应2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+,验证该反应的发生:
方案一:向第一份试液中加入少量酸性KMnO4溶液,紫色褪去,二氧化硫过量,也可使紫色褪去,错误,
方案二:向第二份试液中加入KSCN溶液,再滴加新制的氯水,溶液呈红色,铁离子可使KSCN溶液呈红色,错误,应为先无明显变化,滴加新制氯水,溶液显红色,
可用K3[Fe(CN)6]溶液检验生成的亚铁离子,产生蓝色沉淀,或者检验硫酸根离子:向试液中加入稀盐酸,再滴加BaCl2溶液,析出白色沉淀即可;
故答案为:一和二;K3[Fe(CN)6]溶液,产生蓝色沉淀(或稀盐酸,再滴加BaCl2溶液,析出白色沉淀).
点评 本题是一道硫元素有关离子的检验题,要熟记常见离子的特征离子反应,是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(无水硫酸铜) | ||
| C. | 硝基苯中的混酸(NaOH溶液) | D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ•mol-1,在容器中充入1mol SO2和0.5mol O2充分反应,放出的热量为98.32KJ | |
| C. | 已知在120C、101kPa时,1gH2燃烧生成水蒸气放出121KJ,其热化学方程式表示为H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-242KJ/mol | |
| D. | CO(g) 的燃烧热是283.0kJ•mol-1,则CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+283kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
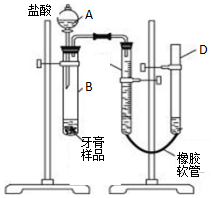 某研究性学习小组对同学们常用的三种品牌牙膏中摩擦剂成分进行调查,结果如表:
某研究性学习小组对同学们常用的三种品牌牙膏中摩擦剂成分进行调查,结果如表:| 某品牌药物牙膏 | 某品牌儿童牙膏 | 某品牌透明牙膏 | |
| 摩擦剂 | 碳酸钙 | 氢氧化铝 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 汽油、酒精、NaCl溶液 | B. | 汽油、四氯化碳、水 | ||
| C. | 汽油、酒精、NaOH溶液 | D. | 汽油、苯、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成该电池的正极和负极必须是两种活性不同的金属 | |
| B. | 放电时每消耗1 mol CH3OH转移12 mol电子 | |
| C. | 放电时电解质溶液的pH逐渐增大 | |
| D. | 放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com