
由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是
A.1∶1∶1 B.2∶1∶1 C.1∶2∶1 D.1∶1∶3
科目:高中化学 来源:2016届甘肃省平凉市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为
A.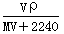 mol/L B.
mol/L B.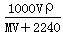 mol/L
mol/L
C.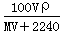 mol/L D.
mol/L D.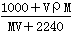 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期开学考试化学试卷(解析版) 题型:填空题
(12分)下列为合成聚合物F的路线图:
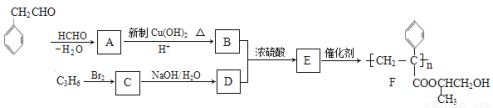

请根据以上信息,回答下列问题:
(1)A中含有官能团的名称是_________ ,C的系统命名是 。
(2)B+D→E的反应类型是_______。
(3)C生成D的反应化学方程式为__________,如果C与NaOH的醇溶液反应,则反应类型为__________。
(4)G物质的相对分子质量比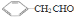 的相对分子质量大2,则符合下列条件的G的同分异构体有_ __种。
的相对分子质量大2,则符合下列条件的G的同分异构体有_ __种。
①分子中含有苯环,且苯环上有两个取代基
②遇氯化铁溶液变紫色
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
以下有关物质的量浓度的叙述正确的是
A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3
B.150 mL 1mol·L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol·L-1的氯化铝溶液中的c(Cl-)相等
C.20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0 mol·L-1,则此溶液中KCl 的质量分数为25.38%
D.20℃时,100 g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2%
查看答案和解析>>
科目:高中化学 来源:2016届江汉油田海南海政学校高三月考化学试卷(解析版) 题型:实验题
(9分)某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作] 将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计方案] 该小组对燃烧后生成的白色物质进行如下探究:
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。 ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀。 ②无明显现象 | 白色物质为Na2CO3 |
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式:__________________。
(2)甲同学认为方案1得到的结论不正确,其理由是________________。
(3)钠在二氧化碳中燃烧的化学方程式为________________。
(4)乙同学认为白色物质有可能是氢氧化钠。你是否同意乙同学的观点,并简述理由:___________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄石市高三9月调研考试化学试卷(解析版) 题型:实验题
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O;
3K2MnO4+ KCl+3H2O;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。
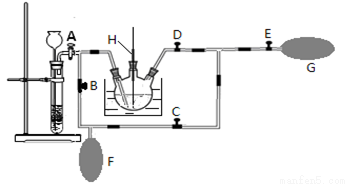
①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞 ,打开旋塞 ,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化完全的实验操作是 。
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至 ,自然冷却结晶,抽滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是____________。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为 (保留4位有效数字,已知M(KMnO4)=158g·mol-1)。若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将 。(填“偏大”、“偏小”、“不变”)
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期起点考试化学试卷(解析版) 题型:实验题
(10 分)为了探究Cu(NO3)2 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.Cu(NO3)2 的氧化性
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
操作 | 反应或现象 | 结论 |
取少量除尽 Cu2+后的溶液于试管中,加入 ① 溶液,振荡 | 现象② | 存在 Fe3+ |
取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6] 溶液,振荡 | 离子方程式③ | 存在 Fe2+ |
Ⅱ.Cu(NO3)2 的热稳定性
在下图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。
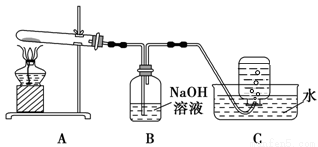
(2)装置B 的作用是 。
(3)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置

(4)下图为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
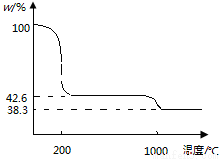
Cu(NO3)2 加热到200℃的化学方程式为 ,继续高温至1000℃生成 (填化学式)固体。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列说法中不正确的是
①水分子的电子式为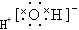 ②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
③氮分子的电子式为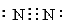 ④只含有离子键的化合物才是离子化合物
④只含有离子键的化合物才是离子化合物
A.①② B.③④ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三优录班8月月考化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com