
��10 �֣�Ϊ��̽��Cu(NO3)2 �������Ժ����ȶ��ԣ�ij��ѧ��ȤС�����������ʵ�顣
��Cu(NO3)2 ��������
����������˿����Cu(NO3)2 ��Һ�У�һ��ʱ�����˿ȡ����Ϊ������Һ��Fe �������������Һ�е�Cu2+��������������ʵ�顣��ѡ�õ��Լ�KSCN ��Һ��K3[Fe(CN)6]��Һ����ˮ��
��1��������±���
���� | ��Ӧ������ | ���� |
ȡ�������� Cu2+�����Һ���Թ��У����� �� ��Һ���� | ����� | ���� Fe3+ |
ȡ�������� Cu2+�����Һ���Թ��У����� K3[Fe(CN)6] ��Һ���� | ���ӷ���ʽ�� | ���� Fe2+ |
��Cu(NO3)2 �����ȶ���
����ͼ��ʾ��ʵ��װ��A �У��þƾ���ƶ�Cu(NO3)2 �����ǿ�ȣ���������ɫ���壬��װ��C���ռ�����ɫ���壬����֤ΪO2������Ӧ�����Ժ��Թ��в�������Ϊ��ɫ��
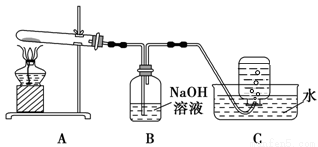
��2��װ��B �������� ��
��3����ʵ�鰲ȫ�Ƕȿ��ǣ���Ҫ��A��B �����װ��M�����ڷ����л���M װ��

��4����ͼΪCu(NO3)2 ��Ʒ���¹��̵��������ߣ���Ʒ��������w%���¶ȱ仯�����ߣ���
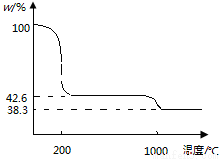
Cu(NO3)2 ���ȵ�200��Ļ�ѧ����ʽΪ ������������1000������ ���ѧʽ�����塣
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��ׯ�и���9�½���ѧ���⻯ѧ�Ծ��������棩 ���ͣ�ʵ����
ʵ������Ҫ0.1 mol��L��1 NaOH��Һ450 mL��0.5 mol��L��1������Һ500 mL��������������Һ����������ش��������⣺
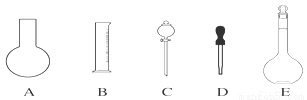
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����___________(�����)������������Һ�����õ��IJ���������_____ (����������)��
��2��������NaOH��Һʱ��
�ٸ��ݼ�����������ƽ��ȡNaOH������Ϊ________g��
����NaOH��Һ��ת��������ƿʱ����������������������ҺŨ��_____(�>������<������)0.1 mol/L��
����NaOH�����ܽ��������������ƿ��ϴ�ձ���ϴ��Һ��������ƿ�����ݣ���������ҺŨ��________(�>������<������)0.1 mol��L��1��
��3��������������Һʱ��
��������������Ϊ98%���ܶ�Ϊ1.84 g��cm��3��Ũ��������Ϊ________(����������һλС��)mL��
�����ʵ������15 mL��20 mL��50 mL��Ͳ��Ӧѡ��________mL��Ͳ��ã�
�����ƹ������������ձ��н�Ũ�������ϡ�ͣ�ϡ��ʱ����������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
����-ϩȲ���칹��Ӧ������Name Reactions����¼���÷�Ӧ�ɸ�Ч������Ԫ�������

��R��R����R����ʾ�⡢�������
�ϳ���Ԫ���л�������J��·�����£�
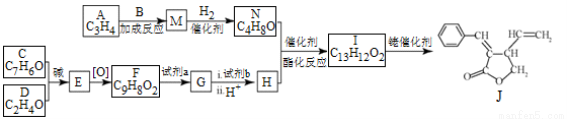
��֪��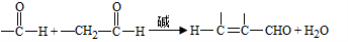
��1��A����Ȳ������ṹ��ʽ�� ��
��2��B��̼���⡢������Ԫ����ɣ���Է���������30��B�Ľṹ��ʽ�� ��
��3��C��D������B��ͬ�Ĺ����ţ�C�Ƿ����廯���E�к��еĹ������� ��
��4��F���Լ�a��Ӧ����G�Ļ�ѧ����ʽ�� ���Լ�b�� ��
��5��M��N��Ϊ�����ʹ���M�Ľṹ��ʽ�� ��
��6��NΪ˳ʽ�ṹ��д��N��H����I��˳ʽ�ṹ���Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭�����ﺣ�Ϻ���ѧУ�����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��FeO��Fe2O3��Fe3O4��ɵĻ������������Ԫ������Ԫ�ص�������Ϊ21��8�������ֻ������FeO��Fe2O3��Fe3O4�����ʵ���֮����
A��1��1��1 B��2��1��1 C��1��2��1 D��1��1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ��ʯ�и���9�µ��п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ľṹ����ͼ��ʾ����֪������ṹ��Ԫ������ԭ����ɵ�����ʮ���壬������20���ȱ������ε����һ����Ŀ�Ķ��㣬ÿ������ϸ���1��Bԭ�ӡ������й�˵������ȷ����

A��ÿ������Ӻ���12����ԭ��
B���������ǿռ���״�ṹ
C�������������60��
D��ÿ������Ӻ���30������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ����㿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�л���Ľṹ��ʽ��ͼ��ʾ���йظ��л����������ȷ����

A�������к���3 �ֹ�����
B����һ�������£��ܷ���ȡ���������������ͼӾ۷�Ӧ
C�������ʷ�������������10 ��̼ԭ����ͬһƽ����
D��1 mol ������������5 mol H2 �����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꼪��ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��۳������Ͻ��̻����Ҫԭ����
A����ֹ���ַ���
B����ֹ��Ⱦ���
C�����������
D����ۿ�����С��������ɢ�ڿ������������ֽӴ���һ��������Ӧ����������ը
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������и���7���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йط�Ӧ�����ӷ���ʽ��д��ȷ����
A����Na����CuSO4��Һ�У�Na+Cu2+=Cu+2Na+
B����NaHSO4��Һ����Ba(OH)2��Һ�������ԣ�H++SO42-+Ba2++OH-=BaSO4��+H2O
C�����Ȼ�����Һ�м���������ˮ��Al3++4NH3?H2O=AlO2-+2H2O+4NH4+
D����Ca(OH)2��Һ��ͨ�����SO2��SO2+ OH-=HSO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ����9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и����е����ӣ�����Һ���ܴ����������
A��Ag+��H+��Cl-��CO32- B��H+��Ba2+��OH-��SO42-
C��Ba2+��K+��Cl-��NO3- D��Ca2+��HCO3-��Cl-��OH-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com