
A、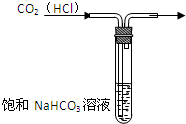 除去混有的杂质气体 |
B、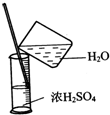 浓硫酸稀释 |
C、 分离出AgNO3溶液中的AgCl |
D、 称量30.46g的NaOH固体 |


科目:高中化学 来源: 题型:
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,将1mL pH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,将1mL pH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、加热HA溶液时,溶液酸性增强 |
| B、1 mol?L-1 HA溶液与1 mol?L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(A-),则2<a<4 |
| C、某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=1014-d mol?L-1 |
| D、HA溶液与NaOH溶液恰好完全反应时,c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | 形成1mol化学键时放出的能量 |
| H-H | 436kJ |
| F-F | 157kJ |
| H-F | 568kJ |
| A、H2与F2反应的热化学方程式为H2(g)+F2(g)═2HF(g)△H=-543 kJ?mol-1 |
| B、2 L HF气体分解成1 L H2(g)和1 L F2(g)吸收543 kJ的热量 |
| C、1 mol H2(g)与1 mol F2(g)反应生成2 mol HF(l)放出的热量小于543 kJ |
| D、在相同条件下,1 mol H2(g)与1 mol F2(g)的总能量小于2 mol HF(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、钾(K)原子基态的原子结构示意图为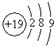 |
B、H2O电子式为 |
| C、Mg的原子基态电子排布式为1s22s22p63s23p1 |
| D、Ca2+离子基态电子排布式为1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用电渗析法将海水淡化 |
| B、利用太阳能将海水蒸馏淡化 |
| C、加入明矾,使海水的盐分沉淀并淡化 |
| D、将海水通过离子交换树脂,以除去所含的盐分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②③ | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com