
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
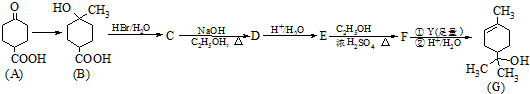
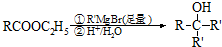
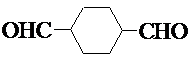 .
.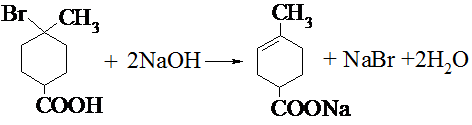 .
.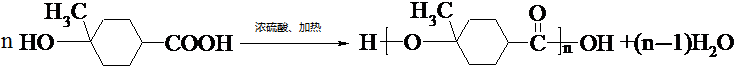 .
.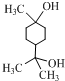 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第③步所需的主要玻璃仪器有:玻璃棒、烧杯、分液漏斗 | |
| B. | 第④步的离子反应方程式:H2O2+2I-+2H+=I2+2H2O | |
| C. | 第⑤步的CCl4可换成苯或酒精 | |
| D. | 该流程中分离出的碘可直接用作“加碘”食盐的碘添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 热化学方程式各物质前的化学计量数只表示分子个数不代表物质的量 | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 对于H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl△H<0,断开1mol H-H键和1mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
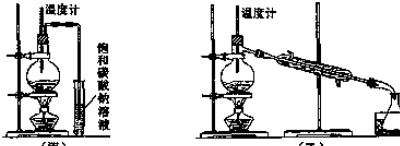
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com