
����Ŀ��ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飮�������������գ� ����һ������250mL 0.1000mol/L NaOH����Һ��
�������ȡ20.00mL����ϡ���������ƿ�У����μ�2��3�η�̪��Һ��ָʾ�������Լ����Ƶı�NaOH��Һ���еζ����ظ������ζ�����4�Σ���¼���������
ʵ���� | NaOH��Һ��Ũ�� | �ζ����ʱ������NaOH��Һ�������mL�� | ����������Һ�������mL�� |
1 | 0.10 | 20.02 | 20.00 |
2 | 0.10 | 20.00 | 20.00 |
3 | 0.10 | 19.98 | 20.00 |
��1������һ��Ҫ�����������ƹ��������Ϊg�����Ʊ���Һ��Ҫ�õ����������ձ��⣬����Ҫ�IJ��������� ��
��2�����������ȡ20.00mL��ϡ�����õ��������� �� �жϵζ��յ�������� ��
��3�������������ݣ��ɼ�����������Ũ��Ϊ ��
��4��������ʵ���У����в���������������ȷ������ɲⶨ���������ҺŨ��ֵ��ƫ�ߵ���
A.���Ʊ���Һ����ʱ����ˮ�����̶�
B.��ƿˮϴ��ֱ��װ����Һ
C.��ʽ�ζ���ˮϴ��δ�ô���ϡ������Һ��ϴ
D.�ζ������յ�ʱ�����Ӷ����ζ��ܶ�����
E.��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ��
���𰸡�
��1��1.0��250mL����ƿ����ͷ�ι�
��2����ʽ�ζ��ܣ����һ��NaOH��Һ����ʱ����Һ��ɫǡ������ɫ��Ϊ��dz����ɫ���Ұ�����ڲ���ɫ
��3��0.10mol/L
��4��ADE
���������⣺��1������һ��Ҫ�����������ƹ��������Ϊ0.25L��0.1mol/L��40g/mol=1.0g�����ձ����ܽ⡢��ȴ��ת�Ƶ�����ƿ�ж��ݣ�����Ҫ����Ϊ250mL����ƿ����ͷ�ιܣ����Դ��ǣ�1.0��250mL����ƿ����ͷ�ιܣ���2�����������ȡ20.00mL��ϡ�����õ�����������ʽ�ζ��ܣ��жϵζ��յ�����������һ��NaOH��Һ����ʱ����Һ��ɫǡ������ɫ��Ϊ��dz����ɫ���Ұ�����ڲ���ɫ�����Դ��ǣ���ʽ�ζ��ܣ����һ��NaOH��Һ����ʱ����Һ��ɫǡ������ɫ��Ϊ��dz����ɫ���Ұ�����ڲ���ɫ����3�������ݿ�֪������NaOH�����Ϊ ![]() =20.00mL��c�����ᣩ=
=20.00mL��c�����ᣩ= ![]() =0.10mol/L�����Դ��ǣ�0.10mol/L�� ��4��A�����Ʊ���Һ����ʱ����ˮ�����̶ȣ�c��NaOH��ƫС�����ĵ�V��NaOH��ƫ����c�����ᣩ=
=0.10mol/L�����Դ��ǣ�0.10mol/L�� ��4��A�����Ʊ���Һ����ʱ����ˮ�����̶ȣ�c��NaOH��ƫС�����ĵ�V��NaOH��ƫ����c�����ᣩ= ![]() ��֪������ɲⶨ���ƫ�ߣ���Aѡ��
��֪������ɲⶨ���ƫ�ߣ���Aѡ��
B����ƿˮϴ��ֱ��װ����Һ����ʵ����Ӱ�죬��B��ѡ��
C����ʽ�ζ���ˮϴ��δ�ô���ϡ������Һ��ϴ��n��HCl��ƫС��V��NaOH��ƫС����c�����ᣩ= ![]() ��֪������ɲⶨ���ƫ�ͣ���C��ѡ��
��֪������ɲⶨ���ƫ�ͣ���C��ѡ��
D���ζ������յ�ʱ�����Ӷ����ζ��ܶ�������V��NaOH��ƫ����c�����ᣩ= ![]() ��֪������ɲⶨ���ƫ�ߣ���Dѡ��
��֪������ɲⶨ���ƫ�ߣ���Dѡ��
E����ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ��V��NaOH��ƫ����c�����ᣩ= ![]() ��֪������ɲⶨ���ƫ�ߣ���Eѡ��
��֪������ɲⶨ���ƫ�ߣ���Eѡ��
���Դ��ǣ�ADE��
�����㾫�����������⣬������Ҫ�˽�����к͵ζ�(�к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ�)��


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgCl2��AlCl3�Ļ����Һ������μ���NaOH��Һֱ�����������ⶨ�������NaOH�����ʵ���(mol)�����ó��������ʵ���(mol)�Ĺ�ϵ����ͼ��ʾ��
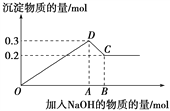
��1��д���������߶η����ķ�Ӧ�����ӷ���ʽ��
OD��________________________________________________��
DC��________________________________________________��
��2��ԭ��Һ��Mg2����Al3�������ʵ���Ũ��֮��Ϊ________��
��3��ͼ��C���ʾ������______mol NaOHʱ��Al3���Ѿ�ת��Ϊ_____��Mg2���Ѿ�ת��Ϊ______��
��4��ͼ���߶�OA��AB��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧѧϰС���ijþ���Ͻ����������ʵ���о���������벢����й����⡣
��ʵ��ҩƷ����
12.6gþ���Ͻ�200ml a mol/Lϡ���ᣬ520ml 4 mol/L NaOH��Һ��
��ʵ�鲽�衿��
�ٽ�12.6gþ���Ͻ���200mL a mol/L��ϡ��������ͼ��ʾװ���г�ַ�Ӧ����Ӧ��ϣ����ռ����ɵ�ȫ�����塣

����b�ڵĻ��Һ����μ���520ml 4 mol/L����������Һ����ֻ�ϣ�������������Һ����500mLʱ���ɵij��������
���������ۡ���
��1������b��������___________________��
��2������ʵ��Ŀ�Ŀ�֪��12.6gþ���Ͻ���200mL a mol/L��ϡ���ᷴӦʱ��Ӧ�ù�����������____________������þ���Ͻ�������ϡ�����������Ա�֤��һ�������ܹ���ȫ��Ӧ��ʣ��������״���£���ʵ�鲽��ٵõ�������Ϊ13.44L����Ͻ���þ����������Ϊ__________________________(������0.1%)��
��3��ʵ�鲽����У���b�ڻ��Һ����μ�����������Һ�����ɵij��������ʱ����ʱ������Һ�е�������__________________���ѧʽ����
��4��ʵ�鲽��ٽ�����ȡ��Ͳ�����ֵ�����ʱ����Ҫע������������ǣ�һ��Ҫ��ȴ�����£�����Ҫ_____________________________������Ҫ��������Ͳ�ڵİ�Һ����ƽ��
��5������a mol/Lϡ�������е�a��ֵΪ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ�أ�����YԪ��ԭ�Ӻ�������������������Ӳ�����3�������������ڱ��е����λ������ͼ��ʾ��
X | Y | |
Z | W |
��ش��������⣺
��1��Wλ�����ڱ��е����ڣ����壻
��2��X���γ�˫ԭ�ӷ��ӣ�����ӵĵ���ʽ����Y����Ԫ���γɵ�10�������г�����+1��������Ϊ���ѧʽ����ͬ����Z����Ԫ���γɵ�18�������г����ĩ�1��������Ϊ��
��3����ҵ�Ͻ������W����ͨ�����ڵ�Z�����п��Ƶû�����Z2W2 �� �����ʿ���ˮ��Ӧ����һ����ʹƷ����Һ��ɫ�����壬0.2mol�����ʲμӷ�Ӧʱת��0.3mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬д��Z2W2��ˮ��Ӧ�Ļ�ѧ����ʽ
��4����һ�������£���Ԫ��Y��Z��ɵ�һ����̬������ɷ�����������Ӧ����Ӧ��ƽ�����������̬���ʹ��棬��֪ÿת��4mol���ӷ���190.0kJ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M��R��X��YΪԭ��������������Ķ���������Ԫ�أ�Z��һ�ֹ���Ԫ�أ�M��̬ԭ��L����p�����������s��������2����R��ͬ����Ԫ��������õĽ���Ԫ�أ�X��M�γɵ�һ�ֻ������������������Ҫ������Ⱦ�Z�Ļ�̬ԭ��4s��3d������������ش��������⣺
��1��R��̬ԭ�ӵĵ����Ų�ʽ�� �� X��Y�е縺�Խϴ��������Ԫ�ط��ţ���
��2��X���⻯��ķе��������������Ƶ�M���⻯���ԭ���� ��
��3��X��M�γɵ�XM3���ӵĿռ乹���� ��
��4��M��R���γɵ�һ�����ӻ�����R2M����ľ�����ͼ��ʾ����ͼ�к���������������������ӷ��ţ���
��5����ϡ�����У�Z����ۺ�����ļ��Σ���ɫ������M��һ���⻯�Z����ԭΪ+3�ۣ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������������ȷ���ǣ�������
A. 22.4LO2���NA��������
B. ��80gNaOH����1Lˮ�У�������Һ��NaOH�����ʵ���Ũ��Ϊ2mol/L
C. ��״���£�22.4LH2O�к��е�ˮ��������NA��
D. 3.4gNH3���еİ�������Ϊ0.2NA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���5gH2 ��11.2LO2 ��2molH2O ��6.02��1023�� CO2���ӡ�
��1��5gH2 �����ʵ�����__________�������__________��
��2��6.02��1023�� CO2���ӵ����ʵ�����__________��������__________��
��3������������������_________��������Żش𣬺�ͬ����
��4������ԭ����������_________��
��5������������_________��
��6�����������_________��
��7�������ܶ�������_________��
��8�����������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ��ص������д�����ǣ� ��
A. ����ԭ��ص������������������ֲ�ͬ�Ľ���
B. ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ��
C. ��ԭ����У�����������һ���Ǹ���������������Ӧ
D. ԭ��طŵ�ʱ�������ķ����Ǵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ���������ȷ�Ӧ���ǣ� ��
A. ����ʯ��ʯ����ʯ��B. ���ȵ�̼��ˮ������Ӧ
C. ʪ����ͭ��Fe+CuSO4��D. Ba��OH��2��8H2O������NH4Cl����ķ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com