
【题目】化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成有关问题。
【实验药品】:
12.6g镁铝合金,200ml a mol/L稀硫酸,520ml 4 mol/L NaOH溶液。
【实验步骤】:
①将12.6g镁铝合金与200mL a mol/L的稀硫酸在如图所示装置中充分反应至反应完毕,并收集生成的全部气体。

②向b内的混合液中逐滴加入520ml 4 mol/L氢氧化钠溶液并充分混合,当氢氧化钠溶液加至500mL时生成的沉淀量最大。
【问题讨论】:
(1)仪器b的名称是___________________。
(2)根据实验目的可知,12.6g镁铝合金与200mL a mol/L的稀硫酸反应时,应该过量的物质是____________(填“镁铝合金”或“稀硫酸”),以保证另一种物质能够完全反应无剩余;若标准状况下,由实验步骤①得到的气体为13.44L,则合金中镁的质量分数为__________________________(保留到0.1%)。
(3)实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时,此时所得溶液中的溶质是__________________(填化学式)。
(4)实验步骤①结束后,读取量筒所呈现的数据时,需要注意的三个问题是:一是要冷却到室温,二是要_____________________________,三是要视线与量筒内的凹液面相平。
(5)在“a mol/L稀硫酸”中的a的值为_____________________。
【答案】 圆底烧瓶 稀硫酸 57.1﹪ Na2SO4 调整量筒液面与广口瓶液面相平 5
【解析】(1).实验装置中用于硫酸和合金反应的容器b是圆底烧瓶,故答案为:圆底烧瓶;
(2).根据实验目的可知测定合金中镁铝的质量分数,实验时需要合金全部反应,所以需要稀硫酸过量;若标准状况下,由实验步骤①得到的气体体积为13.44L,设镁的物质的量为xmol,铝的物质的量为ymol,生成氢气的物质的量为13.44L÷22.4L/mol=0.6mol,则依据反应方程式:Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑得:x+1.5y=0.6,,24x+27y=12.6,联立解方程得:x=0.3mol,y=0.2mol,则镁的质量分数0.3mol×24g/mol÷12.6g×100%=57.1﹪,故答案为:稀硫酸;57.1﹪;
(3).实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时,发生的反应为:Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑、Mg2++2OH=Mg(OH)2↓、Al3++3OH=Al(OH)3↓,分析反应可知,得到生成的沉淀达到最大量时,所得溶液中的溶质为Na2SO4,故答案为:Na2SO4;
(4).实验步骤①结束后,排水量气法读取量筒所呈现的数据时,需要注意水要冷却至室温,调整量筒液面与广口瓶液面相平,使视线与量筒内的凹液面相平,故答案为:调整量筒液面与广口瓶液面相平;
(5). 反应过程中生成最大量沉淀时,依据化学方程式分析判断,相当于硫酸和氢氧化钠全部反应,依据氢离子和氢氧根离子物质的量相等可以得到:200mLamol/L稀硫酸和500ml 4 mol/L氢氧化钠溶液恰好反应,0.2×a×2=0.5×4,a=5,故答案为:5。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)M2R4(g),加入1mol M2和2molR2 , 反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( ) 
A.M2既可能为固体,也可能为气体
B.达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2 , 则R2转化率不变
C.达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍
D.若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 则新的平衡时气体的平均相对分子质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯的传统做法是采用浓硫酸做催化剂,由于浓硫酸具有具有脱水性和强氧性,生成乙烯同时产生CO2和SO2气体会影响乙烯的性质实验.某同学查阅相关资料后发现,可用脱水性更强的P2O5代替浓硫酸浓硫酸作为该实验的催化剂.为验证这一说法,该同学利用以下装置进行实验探究,观察并记录现象如下: 
实验一 | 实验二 | |
实验药品 | 4g P2O5、8mL无水乙醇 | |
实验条件 | 酒精灯加热 | 水浴加热 |
实验现象 | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇,立即产生白雾,当用酒精灯加热后,有气泡产生,并逐渐沸腾,生成粘稠状液体,集气瓶C中有无色液体产生. | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇立即产生白雾,当用水浴加热后,无气泡产生,生成粘稠状液体,集气瓶C中有无色液体产生. |
请回答下列问题:
(1)写出装置中仪器A的名称;
(2)装置中B、C之间长导管的作用是 , 浓硫酸的作用是;
(3)实验二中,完成水浴加热必需的玻璃仪器有、;
(4)实验一、二中当加入无水乙醇时,均有白雾产生,请简述产生白雾的原因:;
(5)经检验集气瓶C中无色液体为磷酸三乙酯,请在图中虚线框内画出实验装置(含试剂)用于验证生成的乙烯;
(6)根据实验现象判断以P2O5作为催化剂获得乙烯的反应条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出元素在周期表中的位置,离子结构示意图以及粒子半径大小比较
(1)Al元素在周期表中的位置;S元素在周期表中的位置 .
(2)S2﹣电子式
(3)粒子半径比较:Mg2+O2﹣ , Mg2+Ca2+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。A应该属于________(用字母代号填写)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)A物质可以使酸性KMnO4溶液褪色,此反应中(填写化学式,下同)_______失去电子,氧化剂是________。
(3)足量的铜片与10mL 18mol/L的浓H2SO充分反应,如果该反应过程中转移了0.1mol电子,生成的CuSO4的物质的量为_______mol,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
(4)计算:将反应后得到的溶液与足量Ba(OH)2溶液混合,充分反应。反应后所得沉淀的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是在其他条件一定时,反应2A+B2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( ) 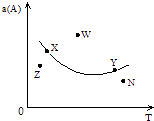
A.X或Y两点相应,V(正)>V(逆)
B.Z、N两点表示未达平衡状态,且都是V(正)>V(逆)
C.W点表示非平衡状态,V(正)>V(逆)
D.相应反应速率大小的点:W>Y>N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空: 步骤一:配制250mL 0.1000mol/L NaOH标准溶液.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作4次,记录数据如表.
实验编号 | NaOH溶液的浓度 | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 20.02 | 20.00 |
2 | 0.10 | 20.00 | 20.00 |
3 | 0.10 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有 .
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是 . 判断滴定终点的现象是 .
(3)根据上述数据,可计算出该盐酸的浓度为 .
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com