
【题目】二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小 。
【答案】
(1)bc
(2)防倒吸(或安全瓶);还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | Ⅰ或Ⅱ | ||
② | 溶液变为蓝色 | ||
③ | 溴水褪色 | ||
④ | Ⅰ或Ⅲ |
(4)常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb
【解析】
试题分析:由图可知,A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸,C中发生SO2+Br2+2H2O=H2SO4+2HBr,D中NaOH溶液吸收尾气。
(1)某同学认为H2SO4也有剩余,则可以检验H+或测定稀硫酸的pH确定稀硫酸的存在;故答案为:b c;
(2)装置B的作用是防倒吸(或安全瓶),C中发生的反应中S元素的化合价升高,则设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-。装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色,故答案为:防倒吸(或安全瓶);还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)①加入几小块CaCO3固体,生成CO2气体,溶液显酸性,可能是Ⅰ或Ⅱ;②如果你漂白粉过量,发生反应NaHSO3+Ca(ClO)2═CaSO4↓+NaCl+HClO,次氯酸氧化碘离子为碘单质,碘遇淀粉变蓝,溶液变为蓝色;③如果你漂白粉不足,溴水被NaHSO3溶液还原,溴水褪色;④如果HSO3-与ClO-刚好反应完,方程式为2NaHSO3+Ca(ClO)2+CaCl2═2CaSO4↓+2NaCl+2HCl滴入加少量酸性KMnO4溶液,溶液显紫色,说明没有还原性物质,反应可能是Ⅰ或Ⅲ;故答案为:①Ⅰ或Ⅱ;②溶液变为蓝色;③溶液褪色;④Ⅰ或Ⅲ;
(4)电离显酸性,水解显碱性,则测定pH即可,则设计实验为常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb,故答案为:常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2==="2AgCl" 。下列说法正确的是
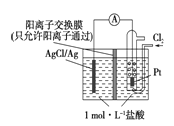
A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH![]() 的物质的量为b mol,下列叙述中一定正确的是
的物质的量为b mol,下列叙述中一定正确的是
A.溶质的质量分数为ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C.溶液中c(OH-)=![]() mol· L-1
mol· L-1
D.上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神十搭载的长征F改进型火箭推进剂之一为无色气体N2O4.N2O4与NO2转换的热化学方程式为:N2O4(g) ![]() 2NO2(g) △H=+24.4KJ/mol
2NO2(g) △H=+24.4KJ/mol
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色 (填“变深”、“变浅”或“不变”),判断理由____________________。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:p(NO2)=p总×x(NO2)。写出上述反应平衡常数Kp表达式 (用p总、各气体物质的量分数x表示)。影响Kp的因素为___________;
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·P2(NO2),其中k正、k逆为速率常数,则Kp为________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×l04s-1,当N2O4分解10%时,v正=__________kPa·s-1;
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为a。保持温度不变,向密闭容器中充人等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列说法正确的是
A.常温常压下,4.4g乙醛所含σ键数目为0.7NA
B.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
C.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
D.50ml浓度为18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体总质量
⑧混合气体总体积
A.①②③④⑤⑥⑦⑧ B.①⑤⑧
C.②⑤⑦ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应属于加成反应的是( )
A.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2═CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
C.CH3COOC2H5+H2O![]() CH3COOH+C2H5OH
CH3COOH+C2H5OH
D.CH2═CH2+H2![]() CH2CH3
CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是
A.该反应的化学方程式是:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1mol,5min后温度升高到830℃,此时测得C为0.4mol时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式:![]() =
=![]() ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com