
【题目】根据π键的成键特征,判断C=C键的键能和C—C键的键能的关系是
A.双键的键能等于单键的键能的2倍B.双键的键能大于单键的键能的2倍
C.双键的键能小于单键的键能的2倍D.无法确定
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下的可逆反应:X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断不合理的是
A. c1:c2=1:3
B. 平衡时,Y和Z的生成速率之比为3:2
C. X、Y的转化率不相等
D. c1的取值范围为0< c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题。
(1)47.5g某二价金属的氯化物中含有1molCl-,则该金属氯化物的摩尔质量为_______ ;该金属的相对原子质量为_______ 。
(2)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(3)已知CO、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(4)将4g NaOH 溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质 的量浓度为_______。
(5)已知ag氢气中含有b个氢原子,则阿伏加德罗常数的值可表示为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2++ H2O(未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
(1)下列关于反应①的说法中错误的是 (选填编号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是: Mn2+> Cu2S
(2)标出反应②中电子转移的方向和数目: MnO4-+ CuS
Ⅱ.在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e → 2H++ O2↑
还原反应:MnO4- + 5e + 8H+→ Mn2++ 4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的物质氧化性强弱的结论是 >___________(填写化学式)。
(4)已知:2KMnO4+ 7H2O2+3H2SO4→ K2SO4+2MnSO4+6O2↑+10H2O,则被1mol KMnO4氧化的H2O2是
mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同温度下发生反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是( )


A. x可能等于1
B. 甲、乙两容器中反应达平衡时,平衡常数K甲<K乙
C. 将乙容器升温可使甲、乙容器内各物质的体积分数相同
D. 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间内有amolA生成的同时生成3amolB;
③A、B、C的浓度不再变化;
④容积不变的密闭容器中混合气体的总压强不再变化;
⑤混合气体的物质的量不再变化;
⑥单位时间消耗amolA,同时生成3amolB ;
⑦A、B、C的分子数目之比为1:3:2。
A.②⑤ B.②⑦ C.①③ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(3) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。
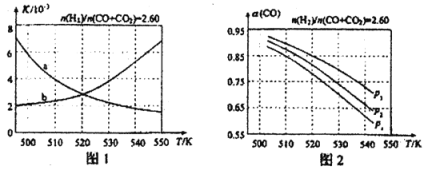
(4)合成气的组成n(2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com