
| A. | 同温同压下,相同体积的物质,它们的物质的量相同 | |
| B. | 常温常压下,等质量的N2与CO所含分子数相同 | |
| C. | 同温同体积下,同质量的H2与O2的压强比约为1:16 | |
| D. | A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1 |
分析 A、同温同压下,相同体积的气体物质,它们的物质的量相同;
B、N2与CO的摩尔质量都是28g/mol;
C、同温同体积下,同质量的H2与O2的压强比与摩尔质量成反应比;
D、在同温同压下,A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1.
解答 解:A、物质的状态不知,所以物质的量不一定相同,故A错误;
B、N2与CO的摩尔质量都是28g/mol,所以等质量的N2与CO所含物质的量相同,分子数相同,故B正确;
C、同温同体积下,同质量的H2与O2的压强比与摩尔质量成反应比,所以同温同体积下,同质量的H2与O2的压强比约为16:1,故C错误;
D、在同温同压下,A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1,而条件不知,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数定律及其推论,题目难度中等,明确阿伏伽德罗常数定律及其推论的内容为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105Pa,64gS02中含有的原子数为3NA | |
| C. | 40gNaOH溶解在1L水中,则其100 mL溶液中含Na+数为0.1NA | |
| D. | 标准状况下,11.2 LH20含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
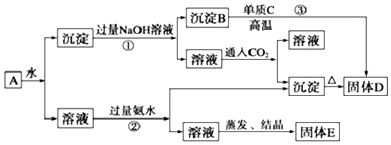
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进入煤矿矿井时,用火把照明 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,蒸发结晶时,当有大量晶体析出时再用玻璃棒搅拌 | |
| D. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离甲苯和二甲苯混合物 | B. | 分离硝酸苯和水的混合物 | ||
| C. | 分离碳酸钡和碳酸钠溶液 | D. | 分离碘的四氯化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
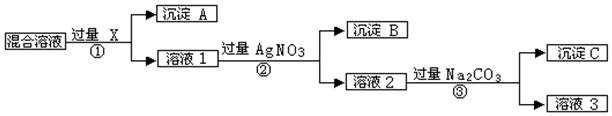
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
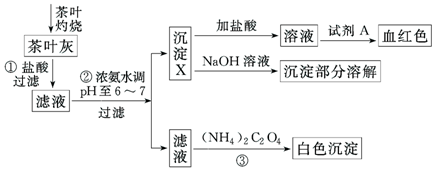
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com