
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
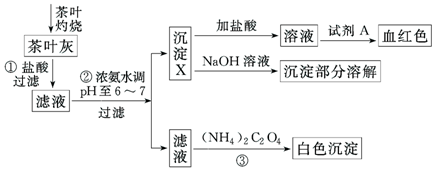
分析 依据流程图分析可知茶叶中含有的少量钙、铁、铝三种元素,灼烧后加入盐酸过滤得到滤液中主要是Ca2+、Al3+、Fe3+,加入浓氨水调节溶液pH为6--7,依据图表分析可知Al3+、Fe3+ 会生成沉淀,沉淀中加入盐酸溶解后分为两份,一份加入硫氰酸钾溶液变红色证明铁离子的存在,另一份加入铝试剂呈玫瑰红色证明含有铝离子;滤液中主要是钙离子,加入草酸铵溶液得到草酸钙沉淀,证明含有钙离子;
(1)依据流程图分析可知,向茶叶灰分中加盐酸的作用是将其中的Ca2+、Al3+、Fe3+溶解;
(2)步骤②在pH为6-7时,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀;
(3)步骤②加入浓氨水在pH为6-7时,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,钙离子不沉淀;
(4)分析流程可知沉淀X为Al(OH)3、Fe(OH)3,Al(OH)3与NaOH溶液反应生成偏铝酸钠和水,步骤③中发生反应是草酸铵和钙离子形成草酸钙沉淀的反应;
(5)溶液1是加入硫氰酸钾溶液检验铁离子的存在.
解答 解:(1)流程图中加入盐酸的作用是溶解物质使钙、铁、铝元素进入溶液有利于进行离子分离,
故答案为:使茶叶中的钙、铁、铝元素转化为离子;
(2)步骤②在pH为6-7时,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,使Fe3+、Al3+转化为沉淀,
故答案为:使Fe3+、Al3+转化为沉淀;
(3)步骤②加入浓氨水在pH为6-7时,依据图表分析可知,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,钙离子不沉淀,
故答案为:Al(OH)3、Fe(OH)3 ;
(4)沉淀X为Al(OH)3、Fe(OH)3,其中Al(OH)3与NaOH溶液反应生成偏铝酸钠和水,化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
过滤后所得滤液中含Ca2+,步骤③中发生反应的离子方程式是检验Ca2+的存在,反应的离子方程式为Ca2++C2O42-=CaC2O4↓,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;Ca2++C2O42-=CaC2O4↓;
(5)依据流程图可知,溶液1中加入的A试剂,所用A试剂是为了检验铁离子的存在,加入的是硫氰酸钾溶液和铁离子形成血红色溶液,故答案为:硫氰化钾溶液.
点评 本题考查了物质性质和组成的实验探究实验分析判断,流程中的试剂特征和反应现象是解题关键,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原理相同 | |
| B. | 由甲苯硝化制三硝基甲苯(TNT)和由甲苯氧化制苯甲酸属于同一种反应类型 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 除去C2H2中的杂质H2S,可依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量相同 | |
| B. | 常温常压下,等质量的N2与CO所含分子数相同 | |
| C. | 同温同体积下,同质量的H2与O2的压强比约为1:16 | |
| D. | A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸、浓盐酸和浓硝酸长期暴露在空气中,质量都会减小、浓度都会降低 | |
| B. | 氯水和活性炭都可使红墨水褪色,其原理相同 | |
| C. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com