
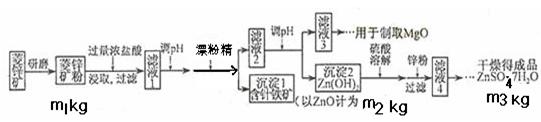
科目:高中化学 来源:不详 题型:填空题
| A.Fe | B.Ca(OH)2 | C.NH3?H2O | D.NaOH |
 生的反应为:
生的反应为: 92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。
92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。查看答案和解析>>
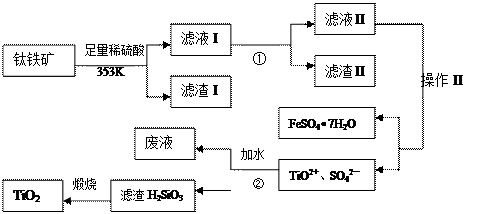
科目:高中化学 来源:不详 题型:单选题
| A.上述生产过程中的尾气可以通入氨水中,生产氮肥 |
| B.电解精炼时,粗铜应与外电源的正极相连 |
| C.反应2Cu2O+Cu2S→6Cu+SO2↑中的Cu2O是氧化剂 |
| D.每生产6mol Cu,理论上需消耗11mol O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

|
 成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。 ▲ (写化学式)。
▲ (写化学式)。 分子筛。
分子筛。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素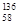 Ce、 Ce、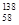 Ce、 Ce、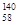 Ce、 Ce、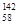 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
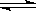 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
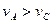
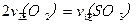
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
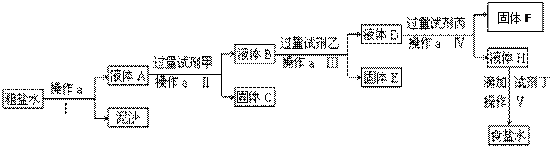
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2在食品工业中可以用来防腐、抗氧化、漂白。 |
| B.合成氨工业需要高温高压催化剂 |
| C.硫酸工业中用水吸收SO3 |
| D.硫酸工业中沸腾炉排出的矿渣可供炼铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com