
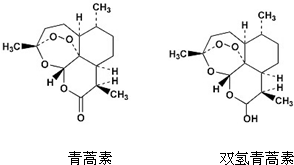
 中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )| A. | 两种有机物官能团的数目相同 | |
| B. | 两种有机物均可以发生取代反应 | |
| C. | 两种有机物均能和NaOH溶液反应 | |
| D. | 1mol双氢青蒿素与金属钠反应可以得到11.2L的氢气 |
分析 A.青蒿素含有酯基、醚键及过氧键,双青蒿素含有含羟基、醚键(2个)及过氧键;
B.酯基、羟基等可以发生取代反应;
C.酯基能与氢氧化钠溶液反应,醚键、羟基、过氧键不能与氢氧化钠反应;
D.羟基能与钠反应生成氢气,生成氢气所处温度、压强不确定,不能计算其体积.
解答 解:A.青蒿素含有酯基、醚键及过氧键3个官能团,双青蒿素含有含羟基、醚键(2个)及过氧键共4个官能团,含有的官能团数目不相等,故A错误;
B.青蒿素中酯基等、双青蒿素中羟基等可以发生取代反应,故B正确;
C.青蒿素含有酯基,能与氢氧化钠溶液反应,但双青蒿素中的醚键、羟基、过氧键均不能与氢氧化钠反应,故C错误;
D.羟基能与钠反应生成氢气,1mol双氢青蒿素与金属钠反应可以得到0.5mol 氢气,但由于生成氢气所处温度、压强不确定,不能计算其体积,故D错误.
故选:B.
点评 本题考查有机物的结构与性质,熟练掌握官能团结构与性质,侧重分析与应用能力的考查,D选项为易错点,容易按标准状况计算氢气体积.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
 +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$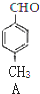 $→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$
$→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$ $→_{浓硫酸△}^{CH_{3}OH}$E
$→_{浓硫酸△}^{CH_{3}OH}$E .
. B.
B.
 D
D
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,46 g乙醇中含有的共价键总数为8 NA | |
| B. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0LpH=12的CH3COONa溶液中OH-一定为0.01NA | |
| B. | 常温下,20g2H2O含有的电子数为10NA | |
| C. | mgNa2O2与水反应产生1molO2时转移电子数为2NA | |
| D. | 标准状况下,22.4LN2和CO的混合物中含用电子对数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性较大的元素在化合物中只能形成负价,不能形成正价 | |
| B. | 若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性不一定强于Y | |
| C. | H元素与F元素的电负性差值达1.9,所以HF属于离子化合物 | |
| D. | 某元素原子外围电子排布式为3d64s2,则此元素可能易显+2和+3价,且+3价稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
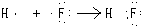 .
.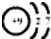 ,写出A、B两元素按1:1原子个数比形成化合物的电子式
,写出A、B两元素按1:1原子个数比形成化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
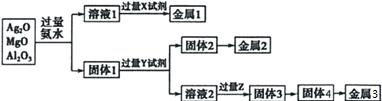
| A. | 可利用淀粉水解产生的X试剂与溶液1反应制金属1 | |
| B. | Y试剂可通过氯碱工业制得 | |
| C. | 过量Z与溶液2的第一步反应是:2OH-+CO2═CO32-+H2O | |
| D. | 工业上用电解固体4法制取金属5,加入冰晶石的作用是降低固体4的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
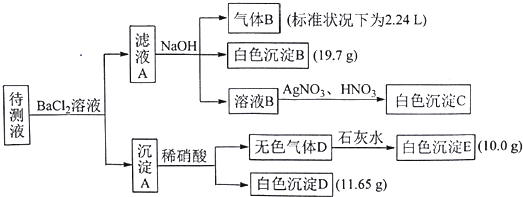
| A. | 向溶液B中加AgNO3与HNO3的操作不是多余的,待测液除含有Na+外,一定含有K+、NH4+、CO32-、HCO3-且c(K+)≥0.1mol•L-1 | |
| B. | 生成白色沉淀B的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| C. | 若无色气体D是单一气体,则原溶液中c(SO42-)=0.05 mol•L-1 | |
| D. | 若无色气体D是混合气体,则沉淀A的成分是BaCO3、BaSO3、BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com