
分析 (1)由滴定原理可知,Na2O2的作用是将铬从+3价氧化为+6价;
(2)过氧化氢有剩余,会将I-氧化为I2,影响测定结果;
(3)氧气会将I-氧化为I2,导致消耗Na2S2O3溶液体积偏大;
(4)根据电子转移守恒:4Cr2O72-~3S2O32-,结合Cr元素守恒:4Cr2O3~4Cr2O72-~3S2O32-,根据关系式计算.
解答 解:(1)由滴定原理:①Cr2O72-+I-+H+→Cr3++I2+H2O,②S2O32-+I2+H2O→SO4 2-+I-+H+(均未配平),可知Na2O2的作用是将铬从+3价氧化为+6价,
故答案为:将铬从+3价氧化为+6价;
(2)过氧化氢有剩余,会将I-氧化为I2,影响测定结果,则上述过程中煮沸的目的是:除去溶液中过氧化物,
故答案为:除去溶液中过氧化物,
(3)氧气会将I-氧化为I2,导致消耗Na2S2O3溶液体积偏大,会导致测定结果偏大,
故答案为:偏大;
(4)①中铬从+6价降低为+3价,②中S元素从+2升高为+6,根据电子转移守恒:4Cr2O72-~3S2O32-,结合Cr元素守恒:2Cr2O3~2Cr2O72-~3S2O32-,
设样品中Cr2O3的质量分数为w,则:
4Cr2O3~4Cr2O72-~3S2O32-
608g 3mol
0.0600g×w 0.0100mol•L-1×0.015L
所以608g:0.0600g×w=3mol:0.0100mol•L-1×0.015L
解得w=50.67%,
故答案为:50.67%.
点评 本题考查氧化还原反应反应滴定计算,关键是明确实验原理,掌握多步计算中利用关系式进行解答,是对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题
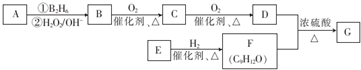
 ;该反应的反应类型为酯化反应或取代反应
;该反应的反应类型为酯化反应或取代反应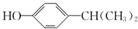
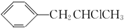 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):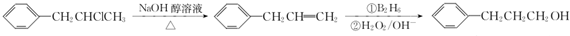 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
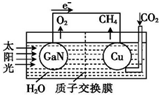 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )| A. | 该装置只有化学能转化为电能 | |
| B. | 氮化镓电极是阴极 | |
| C. | 导线中经过2mol的电子,氮化镓电极生成1molO2 | |
| D. | 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
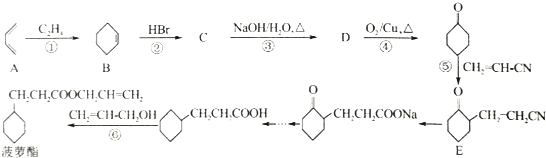
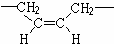 ,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.
,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001. .
.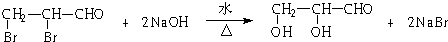 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01kJ•mol-1 |
| 反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
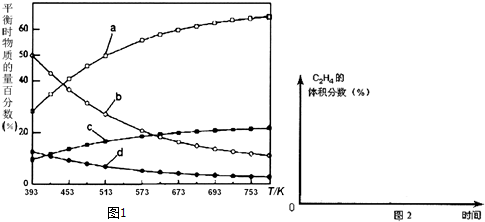
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
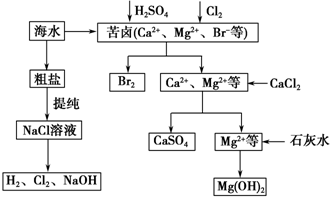
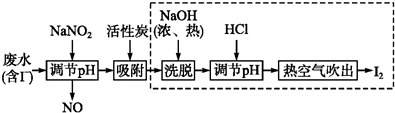
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
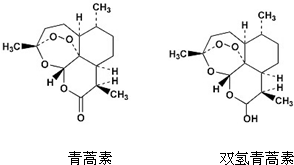 中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )| A. | 两种有机物官能团的数目相同 | |
| B. | 两种有机物均可以发生取代反应 | |
| C. | 两种有机物均能和NaOH溶液反应 | |
| D. | 1mol双氢青蒿素与金属钠反应可以得到11.2L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
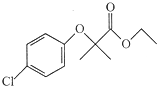 )是临床一种应用广泛的药物,它的一条合成路线如下:
)是临床一种应用广泛的药物,它的一条合成路线如下: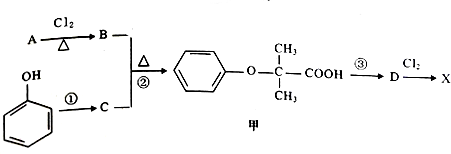
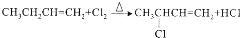
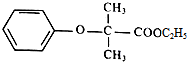 .
. 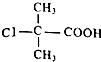 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$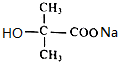 +NaCl+H2O.
+NaCl+H2O. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com