
下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正
确的是
| 元素代号 | X | Y | Z | W | N |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.099 | 0.160 |
| 主要化合价 | +1 | -2 | -2、+6 | +7、-1 | +2 |
A.X 与W形成的化合物可能是共价化合物
B.常温下单质与水反应速率:X > N
C.最高价氧化物对应水化物酸性:W > Z
D.一种18电子的含Y的化合物属于共价化合物
科目:高中化学 来源: 题型:
下列关于 0.2 mol/L 硝酸钾溶液的叙述中,正确的是 ( )
A.1 L 该溶液中含硝酸钾 202 g B.100 mL 该溶液中含硝酸钾 0.02 mol
C.从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L
D.1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,消除氮氧化物污染有多种方法。
⑴用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g) ΔH=-574 kJ·mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式__________
⑵用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据是_______
A.容器内CO2的浓度保持不变 B.v正(N2)=2 v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为 (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______。
⑶合成塔失去活性的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为:
Zn(s) +2MnO2 (s) +H2O(l) = Zn(OH)2 (s) +Mn2O3(s) ,该电池正极的电极反应式是
。PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是; 若电解液中不加入Cu(NO3)2这样做的主要缺点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铜既能与稀硝酸反应.也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:
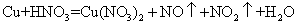 (未配平)
(未配平)
①硝酸在该反应中的作用是__________________,
②19.2g Cu被硝酸完全溶解后,若得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是__________________。
(2)①已知白磷和氯酸溶液可发生如下反应:
P4 + HClO3 + === HCl + H3PO4
配平上述反应方程式,并表示电子转移的方向和数目。
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O === 20Cu3P + 24 H3PO4 + 60 H2SO4
在该反应中30molCuSO4可氧化P4的物质的量是 。
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下它能使工业废气中的氮的氧化物、SO2等分解,减小工业废气对环境的影响,它可由铁酸锌(ZnFe2O4)经高温还原制得。转化流程如图所示:
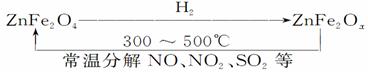
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x=________。写出铁酸锌高温被H2还原生成氧缺位铁酸锌的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。回答下列问题:
(1)C、D、E三种元素的简单离子按半径由小到大的顺序为(用离子符号表示)______________。
(2)元素B与D的电负性的大小关系是___________,
(3)C与E的第一电离能的大小关系是___________,(填﹥、﹤、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子构型____________________。
(5)C的氧化物溶于NaOH中的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的装置,C、D、E、F均为惰性电极.将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:(1)电极A是正极填“正极”或“负极”)
(2)甲装置中C极的电极反应式为.
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,所得溶液在25℃时的pH=.
(4)欲用丙装置给铜镀银,G应该是银(填“铜”或“银”),电镀液的主要成分是(填化学式).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com