
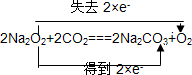 ,故答案为:
,故答案为: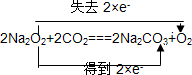 ;
;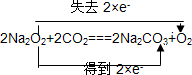 可知若转移3mol电子,则所产生的氧气为1.5mol,体积为1.5mol×22.4L/mol=33.6L,故答案为:33.6L.
可知若转移3mol电子,则所产生的氧气为1.5mol,体积为1.5mol×22.4L/mol=33.6L,故答案为:33.6L.


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a一定大于0.01 |
| B、反应后溶液中一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| C、反应后溶液中一定有c(CH3COO-)+c(CH3COOH)>c(Na+) |
| D、反应后溶液中一定有c(Na+)>c(CH3COO-)>c(H+)=c(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 右图为摇摆电池(Rockingchair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C
右图为摇摆电池(Rockingchair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C| 充电 |
| 放电 |
| A、放电时,负极反应LiCoO2-xe-═Li(1-x)CoO2+xLi+ |
| B、充电时,A极发生氧化反应 |
| C、充电时,Li+穿过隔离膜向B极移动 |
| D、当B极失去Xmol电子,电池消耗6 mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.铁是人体必须的微量元素,绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成份.
I.铁是人体必须的微量元素,绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成份.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1mol?L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | ||
| B、在0.1mol?L-1Na2CO3溶液中:Al3+、Ba2+、NO3-、Cl- | ||
| C、在0.1mol?L-1FeCl3溶液中:K+、NH4+、I-、SCN- | ||
D、在
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com