
【题目】Ⅰ.羟基磷酸钙[Ca10(PO4)6(OH)2]具有优良的生物相容性和生物活性,它在口腔保健中具有重要作用,可以防止龋齿等,回答下列问题。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是___。
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的键角关系是PH3___NH3(填“>”或“<”),PO43-离子空间构型是___。
(3)现已合成含钙的全氮阴离子盐,其中阴离子N5-为平面正五边形结构,N原子的杂化类型是___。
(4)碳酸钙的分解温度远高于碳酸镁,其原因是___。
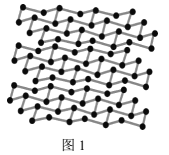
(5)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图1所示:其中最小的环为6元环,每个环平均含有___个P原子。
Ⅱ.钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图2所示。
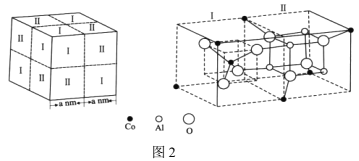
(6)基态Co原子的价电子排布式为___。该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,NA为阿伏加德罗常数的值,钴蓝晶体的密度为___ g·cm-3(列计算式)。
【答案】O>P>H>Ca 小于 正四面体 sp2 镁离子半径小于钙离子半径,与氧离子形成的离子键更强,晶格能更大,因此碳酸镁的热分解温度低 2 3d74s2 CoAl2O4 ![]()
【解析】
(1)同周期从左到右元素的电负性变大,同主族从上到下电负性变小,Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是O>P>H>Ca;
(2)NH3和PH3的空间构型都是三角锥型,但是,NH中N-H键的键长比PH中P-H键的键长要短,所以在NH3中,成键电子对更靠近,排斥力更大,以致键角更大。而PH3中成键电子对之间的斥力减小,孤对电子对成键电子的斥力使H-P-H键角更小。PH3与同主族元素N形成的氢化物的键角关系是PH3<NH3;PO43-中心原子为P,其中σ键电子对数为4,中心原子孤电子对数=![]() ×(5+3-4×2)=0,PO43-中心原子价层电子对对数为4+0=4,P原子sp3杂化,PO43-离子空间构型是正四面体。
×(5+3-4×2)=0,PO43-中心原子价层电子对对数为4+0=4,P原子sp3杂化,PO43-离子空间构型是正四面体。
故答案为:<;正四面体;
(3)含钙的全氮阴离子盐,阴离子N5-为平面正五边形结构,中心原子N,其中σ键电子对数为2,中心原子存在大π键,所以N原子的杂化类型是sp2。
故答案为:sp2;
(4)由于镁离子半径小于钙离子半径,与氧离子形成的离子键更强,晶格能更大,因此,碳酸镁的热分解温度低。
(5)黑磷与石墨烯类似,其中最小的环为6元环,每个环平均含有6×![]() =2个P原子。
=2个P原子。
故答案为:2
(6)基态Co原子的价电子排布式为3d74s2;I、II各一个小正方体为一个晶胞,该晶胞中Co原子个数=(4×![]() +2×
+2×![]() +1)×4=8、Al原子个数=4×4=16、O原子个数=8×4=32,Co、Al、O原子个数之比=8:16:32=1:2:4,化学式为CoAl2O4;该晶胞体积=(2a×10-7 cm)3,钴蓝晶体的密度=
+1)×4=8、Al原子个数=4×4=16、O原子个数=8×4=32,Co、Al、O原子个数之比=8:16:32=1:2:4,化学式为CoAl2O4;该晶胞体积=(2a×10-7 cm)3,钴蓝晶体的密度=![]() =
=![]() g·cm-3(列计算式)。
g·cm-3(列计算式)。
故答案为:3d74s2;CoAl2O4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是

A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.图1,a点表示的溶液通过升温可以得到b点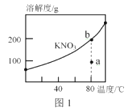
B.图2,若使用催化剂E1、E2、ΔH都会发生改变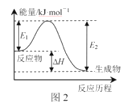
C.图3表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况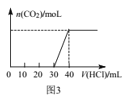
D.图4表示反应aA(g)+bB(g)![]() cC(g),由图可知,a+b>c
cC(g),由图可知,a+b>c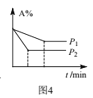
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___(填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显___价;根据价层电子对互斥理论判断SO42-的空间构型为___。
(3)与N3-互为等电子体的分子有___(写两种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气无害化处理反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。下列说法正确的是
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
A. 升高温度可使该反应的正反应速率增大,逆反应速率减小
B. 增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染
C. 该反应反应物总能量小于生成物总能量
D. 使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.苯和氯气生成C6H6Cl6的反应是取代反应
B.可以用溴水鉴别苯和四氯化碳溶液
C.等物质的量的甲烷与氯气反应,有机产物只有CH3Cl
D.1mol![]() 最多可与4molH2发生加成
最多可与4molH2发生加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式。
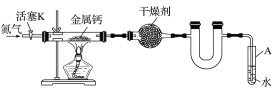
按图连接好实验装置。检查装置的气密性,方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杂志Joule中题为“Li—CO2 Electrochemistry:A New Strategy for CO2 Fixation and Energy Storage”的文章,阐述关于电化学技术固定CO2新的反应途径。下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用的Li—CO2电池组成为钌电极/CO2—饱和LiClO4—DMSO电解液/锂片。下列说法错误的是
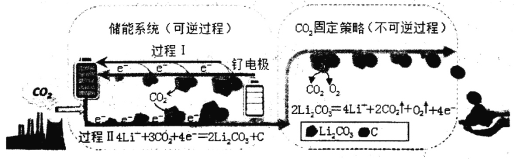
A.钌电极为负极,其电极反应式为:2Li2CO3+C—4e-=== 3CO2+4Li+
B.Li—CO2电池电解液由LiClO4—DMSO溶于水得到
C.这种电化学转化方式不仅减少CO2的排放,还可将CO2作为可再生能源载体
D.CO2的固定中,每生成1.5mol气体,可转移2mole-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com